
| A. | 大于32.8% | B. | 小于32.8% | C. | 等于32.8% | D. | 约等于32.8% |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
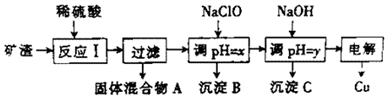
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
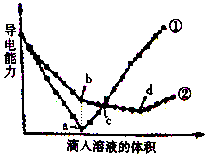 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molCO+2.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| B. | 1.0molCO+2.0molH2O(g)+0.5molHe | |
| C. | 1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
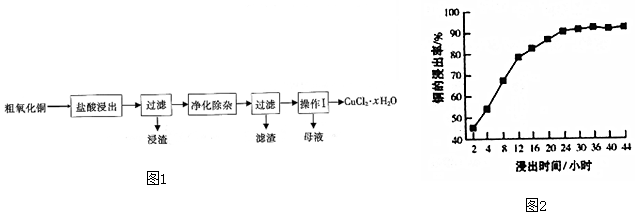
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
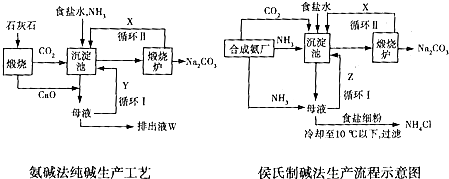
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体A的平衡转化率大于气体B的平衡转化率 | |
| B. | 物质D的聚集状态一定是气体 | |
| C. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 | |
| D. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
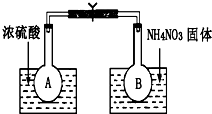 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com