

���� ��1���ʱ���ڶ������յ�������ȥ�ɼ��ͷŵ�������
��2��������ȼ�ղ���Ϊˮ�����ȶࡢ��Դ�㣻
��3��ˮ�ֽ������������о���Ч������������Դ�����ٻ�ʯ��Դʹ�ã�
��4������ȼ�ϵ����ͨ������Ϊ������ͨ������һ��Ϊ���������������ƶ������ӴӸ�������������
��� �⣺��1���ʱ���ڶ������յ�������ȥ�ɼ��ͷŵ���������H2 ��g��+$\frac{1}{2}$O2��g���TH2O��g����H=436+249-930=-245kJ/mol��
�ʴ�Ϊ��-245��
��2��������ȼ�ղ���Ϊˮ�����ȶࡢ��Դ�㣬����������������ȼ�ϵĵ������ŵ�Ϊȼ�ղ�����ˮ��
�ʴ�Ϊ��ȼ�ղ�����ˮ��
��3��a��������ȼ�գ�����ȼ���о���ˮ���ֽ������£�ʹ������Ϊȼ�ϣ�������ʵ�֣���a����
b��Ѱ�Ҹ�Ч�Ĵ�����ʹˮ�ֽ������������Ҫ�����������������ͷ���������b����
c��Ѱ�����⻯ѧ���ʣ����ڿ���������Դ���Էֽ�ˮ��ȡ��������ʹ��̫����ʹˮ�ֽ⣬��c��ȷ��
d��Ѱ�Ҹ���Ļ�ʯȼ�ϣ�������ȼ�շ��ȣ�ʹˮ�ֽ�����������˷��˻�ʯ��Դ���������о�����d����
�ʴ�Ϊ��c��
��4���ٵ缫b�������õ����ӣ�������ԭ��Ӧ��Ϊ��ȼ�ϵ�ص��������ʴ�Ϊ������
�ڵ�ع���ʱ�����������ƶ�����Һ�е�OH-����a�����ʴ�Ϊ��a��
�۵�ع���ʱ�����ӻ������·�ж����ƶ����Ӹ�����������������ӵ��ƶ�����Ϊa��b���ʴ�Ϊ��a��b��
���� ���⿼�鷴Ӧ�����ʱ䡢ԭ��ء���Դ�ȣ�Ϊ��Ƶ���㣬���շ�Ӧ�������仯��ԭ��صĹ���ԭ������Դʹ��Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע����ٻ�ʯ��Դʹ�ÿ�������Դ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ȼ�ϵ�������Խ����е�������Ӧʽ��O2+4H++4e-�T2H2O | |
| B�� | ��������������̼����������ⱥ���Ȼ�����Һ�����ӷ���ʽΪ��2C1-+2H2O$\frac{\underline{\;���\;}}{\;}$H2��+Cl2��+2OH- | |
| C�� | ��ͭ����ʱ�����Դ�����������Ǵ�ͭ���缫��ӦʽΪ��Cuһ2e-=Cu2+ | |
| D�� | ��ӦHCl��aq��+NaOH��aq���TNaCl��aq��+H2O��l����H��0�������������������ԭ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ����� | �ζ�ǰ����/mL | �ζ������/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����32.8% | B�� | С��32.8% | C�� | ����32.8% | D�� | Լ����32.8% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
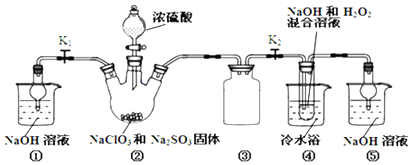
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
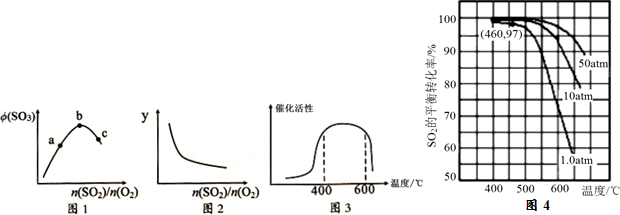
 ���淴ӦA������+aB��g��?C��g��+D��g��������aΪ����������Ӧ�����У���������������ʱ��C�İٷֺ�����C%�����¶ȣ�T����ѹǿ��p���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
���淴ӦA������+aB��g��?C��g��+D��g��������aΪ����������Ӧ�����У���������������ʱ��C�İٷֺ�����C%�����¶ȣ�T����ѹǿ��p���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
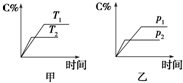
 һ���¶��£���1mol A��1mol B�������2L�ܱ�������������ӦA��g��+B��g��?xC��g��+D��s����t1ʱ�ﵽƽ�⣮��t2��t3ʱ�̷ֱ�ı䷴Ӧ��һ���������������������C��Ũ����ʱ��仯��ͼ��ʾ������˵����ȷ�ǣ�������
һ���¶��£���1mol A��1mol B�������2L�ܱ�������������ӦA��g��+B��g��?xC��g��+D��s����t1ʱ�ﵽƽ�⣮��t2��t3ʱ�̷ֱ�ı䷴Ӧ��һ���������������������C��Ũ����ʱ��仯��ͼ��ʾ������˵����ȷ�ǣ�������| A�� | �÷�Ӧ����ʽ�е�x=l | |
| B�� | 0��t1ʱ����A��ʾ�ķ�Ӧ���ʦԣ�A��=0.50mol/��L•min�� | |
| C�� | t2��t3ʱ���ı�������ֱ��Ǽ����������ȥ��������D | |
| D�� | t1��t3�䣬�÷�Ӧ��ƽ�ⳣ����Ϊ4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| t/min | 2 | 4 | 7 | 9 |
| n��H2O��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KԽ�ﵽƽ��ʱ����Ӧ���еij̶�Խ�� | |
| B�� | KԽС���ﵽƽ��ʱ����Ӧ���ת����Խ�� | |
| C�� | K�淴Ӧ��Ũ�ȵĸı���ı� | |
| D�� | K���¶Ⱥ�ѹǿ�ĸı���ı� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com