
| A. | 0.5molCO+2.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| B. | 1.0molCO+2.0molH2O(g)+0.5molHe | |
| C. | 1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4mol H2 |
分析 恒温恒容下,该反应前后气体体积不发生变化,将物质全部转化到左边满足n(H2O):n(CO)=2:1,为等效平衡,当反应达平衡时,CO的转化率为α,如将生成物全部转化为生成物,如n(H2O):n(CO)>2:1,则CO的转化率大于α,如n(H2O):n(CO)<2:1,则CO的转化率小于α,以此解答该题.
解答 解:恒温恒容下,该反应前后气体体积不发生变化,将物质全部转化到左边满足n(H2O):n(CO)=2:1,为等效平衡,CO的转化率为α,
A.等效为开始加入1.5molCO、3molH2O(g),n(H2O):n(CO)=2:1,与原平衡为等效平衡,CO的转化率为α,故A不选;
B.等效为在原平衡基础上加入0.5molHe,恒温恒容下平衡不移动,CO的转化率为α,故B不选;
C.1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2,等效为开始加入2molCO、2molH2O(g),n(H2O):n(CO)<2:1,达平衡时CO的转化率小于α,故C选;
D.原平衡等效为开始加入0.9molCO、1.9molH2O(g),n(H2O):n(CO)>2:1,则CO的转化率大于α,故D不选.
故选C.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及等效平衡等,理解等效平衡规律是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 |
| n(CO)/mol | 10 | 7 | 5 | 5 |
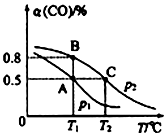
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
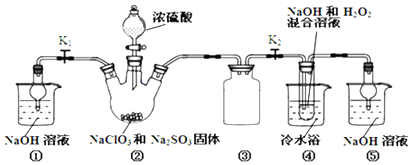
| 实验序号 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于32.8% | B. | 小于32.8% | C. | 等于32.8% | D. | 约等于32.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
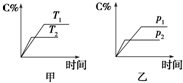 可逆反应A(?)+aB(g)?C(g)+D(g),其中a为正整数.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.试回答下列问题:
可逆反应A(?)+aB(g)?C(g)+D(g),其中a为正整数.反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 | |
| D. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com