
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 | |
| D. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 |
分析 选项中均为放热反应,焓变为负,放出的热量越多,焓变越小,结合物质的气态能量>液态能量>固态能量、完全燃烧放出的热量多、物质的量与热量成正比来解答.
解答 解:A.C(s)+O2(g)=CO2(g)为完全反应,放出的热量多,则△H1>△H2,故A不选;
B.物质的量与热量成正比,则H2(g)+Cl2(g)=2HCl(g)放出热量多,则△H1>△H2,故B不选;
C.S的气态能量>固态能量,产物相同,则S(g)+O2(g)=SO2(g)放出热量多,则△H1<△H2,故C选;
D.反应物相同,水的气态能量>液态能量,则2H2(g)+O2(g)=2H2O(l)放出热量多,则△H1>△H2,故D不选;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、状态与能量、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意焓变为负,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5molCO+2.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| B. | 1.0molCO+2.0molH2O(g)+0.5molHe | |
| C. | 1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体A的平衡转化率大于气体B的平衡转化率 | |
| B. | 物质D的聚集状态一定是气体 | |
| C. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 | |
| D. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C(s)+H2O(g)?CO(g)+H2(g)反应,在一定条件下达到平衡,增加或减少C(s)的量平衡不移动 | |
| B. | 对于2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志 | |
| C. | 对于C(s)+CO2(g)?2CO(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志 | |
| D. | 对于I2(g)+H2(g)?2HI(g)反应,加入催化剂或增大压强均能缩短达到平衡所用时间,但HI的百分含量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=-131.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
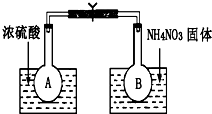 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③ | C. | ②④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com