
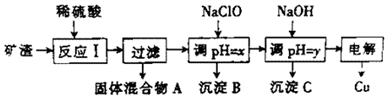
| ������ | Cu��OH��2 | Al��OH��3 | Fe��OH��3 | Fe��OH��2 |
| ��ʼ����pH | 5.4 | 4.0 | 2.2 | 5.8 |
| �������pH | 6.7 | 5.2 | 3.2 | 8.8 |
���� ��������ϡ���ᣬCu2O��Al2O3��Fe2O3�ܽ⣬�������費�ܣ����Թ�������A�Dz�����ϡ��������ʣ������ķ�Ӧ��Cu2O+2H+=Cu+Cu2++H2O���ó�A�ijɷ���SiO2��Cu��
���ڵ���Cu���ڣ���Ԫ����Fe2+��ʽ���ڣ���Ӧ����ʽ��2Fe3++Cu=Cu2++2Fe2+����Һ����Ҫ��Al3+��Fe2+��Cu2+��
����NaClO���������ԣ�����Fe2+ΪFe3+��ͬʱ������ҺpHʹAl3+��Fe3+������ȫ������Fe��OH��3��Al��OH��3��ʼ�����ͳ���������pH��ϵ��x��Χ�ǣ�3.2��pH��4.0��Ŀ���dz���Fe��OH��3��y��Χ�ǣ�5.2��pH��5.4������Al��OH��3�����õ��Ȼ�ͭ������ͭ��Һ����ⷨ��ȡCuʱ������������ԭ��Ӧ��Cu2++2e-=Cu����������������Ӧ��2Cl--2e-=Cl2�������������еĴ�����������Һ�е������ӣ�PH���ߣ�NaClO�ܵ���pH����Ҫԭ�������ڷ�����ӦClO-+H+?HClO��ClO-����H+���Ӷ��ﵽ����pH��Ŀ�ģ���Һ��ʾ���ԣ������������ᣬ��������������Һ�е������ӣ�����һ�־���Ư�����õ������Ǵ����
��1����ӦI�У�����Ԫ���йط�Ӧ��Fe2O3���ܽ��Fe3+�ܽ�ͭ��
��2��ͨ�����Ϸ���֪��y����ֵ��Χ��5.2��pH��5.4��
��3�����ϲ����е�NaOH���ڵ���pHʹAl3+��Fe3+������ȫ��
��4���������У���������������Ӧ��
��5����NaClO��pH�����ɳ���B��ͬʱ����һ�־���Ư�����õ����ʣ�����B������������Ư����������HClO���Ҹ������뻹ԭ��������ʵ���֮��Ϊ4��1���ݴ���д�÷�Ӧ�����ӷ���ʽ��
��� �⣺��1����ӦI�У�����Ԫ���йط�Ӧ�У�Fe2O3+6H+�T2Fe3++3H2O��2Fe3++Cu�T2Fe2++Cu2+��
�ʴ�Ϊ��Fe2O3+6H+�T2Fe3++3H2O��2Fe3++Cu�T2Fe2++Cu2+��
��2��ͨ�����Ϸ���֪������y��Ŀ���dz�ȥ�����Ӷ����ܳ�ȥͭ���ӣ�����y����ֵ��Χ��5.2��pH��5.4��
�ʴ�Ϊ��5.2��pH��5.4��
��3�����ϲ����е�NaOH���ڵ���pHʹAl3+��Fe3+������ȫ���ֲ��������ʣ���ѡCuO��Cu��OH��2��
�ʴ�Ϊ��AC��
��4���������У���������������Ӧ��2Cl--2e-=Cl2����4OH--4e-=O2��+2H2O��
�ʴ�Ϊ��Cl2��O2��
��5����NaClO��pH�����ɳ���B��ͬʱ����һ�־���Ư�����õ����ʣ�����B������������Ư����������HClO���Ҹ������뻹ԭ��������ʵ���֮��Ϊ4��1���ݴ���д�÷�Ӧ�����ӷ���ʽΪ2Fe2++5ClO-+5H2O=2Fe��OH��3+Cl-+4HClO��
�ʴ�Ϊ��2Fe2++5ClO-+5H2O=2Fe��OH��3+Cl-+4HClO��
���� ���⿼�����ʷ�����ᴿ��Ϊ��Ƶ���㣬�漰������ԭ��Ӧ�����ӷ���ʽ����д������������pH�жϵ�֪ʶ�㣬��ȷ��Ӧԭ�����������������ǽⱾ��ؼ����ѵ����жϵ�����Һ��pH����Ŀ�Ѷ��еȣ�


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȡˮ��Ͳ�����ԭ���о��д��� | |
| B�� | ��ͨ�����ǵ�ľ�Ե�壬�������Ĺ��������ǻ����̶����۵� | |
| C�� | ��ͨ�����׳�ˮ���� | |
| D�� | �����ι�ҵʹ�õ�ÿһ��ԭ�϶����й� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2��H2S | B�� | NH3��CO2 | C�� | Cl2��CO2 | D�� | SO2��Cl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O��Na2O2���Ǽ��������� | |
| B�� | ��ʯ������ˮ��Ӧ�����������ﰱ�� | |
| C�� | �Ӻ�ˮ����ȡ���ʶ�����ͨ����ѧ��Ӧ����ʵ�� | |
| D�� | �Ȼ�����һ�������͵���ʣ������ڵ�ⷨ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ȼ�ϵ�������Խ����е�������Ӧʽ��O2+4H++4e-�T2H2O | |
| B�� | ��������������̼����������ⱥ���Ȼ�����Һ�����ӷ���ʽΪ��2C1-+2H2O$\frac{\underline{\;���\;}}{\;}$H2��+Cl2��+2OH- | |
| C�� | ��ͭ����ʱ�����Դ�����������Ǵ�ͭ���缫��ӦʽΪ��Cuһ2e-=Cu2+ | |
| D�� | ��ӦHCl��aq��+NaOH��aq���TNaCl��aq��+H2O��l����H��0�������������������ԭ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | 0 | 1 | 3 | 5 |
| n��CO��/mol | 10 | 7 | 5 | 5 |
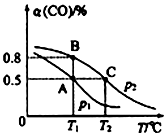
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����32.8% | B�� | С��32.8% | C�� | ����32.8% | D�� | Լ����32.8% |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com