
(16分)氯元素是生产生活中常见的非金属元素
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式: 。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
① NaCl和Cl2中化学键的类型分别是 和 。
② 燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③ 已知:
2H2O2(l) === 2H2O(l)+O2(g) ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g) === H2O(l) ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g) === 2HCl(g) ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
(4)工业上通过如下转化可制得KClO3晶体:
NaCl溶液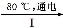 NaClO3溶液
NaClO3溶液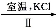 KClO3晶体
KClO3晶体
完成Ⅰ中电解过程中阳极的反应式: 。
(5)一定条件下,在水溶液中1 mol Cl-、ClO-x(x=1,2,3,4)的能量(kJ)相对大小如下图所示。
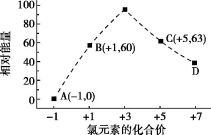
①D是 (填离子符号)。
②B A+C反应的热化学方程式为 (用离子符号表示)。
A+C反应的热化学方程式为 (用离子符号表示)。
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:2016届江苏省高三上学期10月月考化学试卷(解析版) 题型:填空题
金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子。碳元素在周期表中的位置是 ,Q是 ,R的电子式为 ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为 ,除去粗产品中少量钠的试剂为 ;
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2.现将20.0g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1mol氢气,生成氢气的离子方程式为 ,将滤液稀释到1L,若所得Na2SiO3的物质的量浓度为0.17mol· L-1,则SiC的纯度为_____________;
(4)下列叙述正确的有 (填序号)
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
③钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1∶2
④水晶、干冰熔化时克服粒子间作用力的类型相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二9月月考化学试卷(解析版) 题型:选择题
下图曲线a表示反应X(g)+Y(g) +N(s)  Z(g)+M(g) △H<0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g) △H<0进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
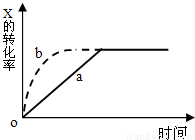
A.升高温度
B.加大N的投入量
C.缩小体积
D.加大X的投入量
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三第二次月考化学试卷(解析版) 题型:选择题
下列各项操作中不发生先沉淀后溶解现象的是
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO2
④向石灰水中通入过量CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸
A.①②③ B.①②⑤ C.①②③⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源:2016届河南省三门峡市高三上学期第一次精英对抗赛化学试卷(解析版) 题型:填空题
(10分) 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:
2FeSO4 + a Na2O2 = 2Na2FeO4 + b X + 2Na2SO4 + c O2↑
①该反应中物质X应是 ,a与c的关系是 。
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: 。
②每生成1mol FeO42-转移 mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州市高三上学期第二次质量检测考试化学试卷(解析版) 题型:选择题
氯原子对O3的分解有催化作用:
O3+Cl==ClO+O2 ΔH1,ClO+O == Cl+O2 ΔH2。大气臭氧层的分解反应是:O3+O === 2O2 ΔH,该反应的能量变化如图所示,则下列叙述正确的是

A.反应O3+O === 2O2的ΔH = E1-E3
B.反应O3+O === 2O2是吸热反应
C.ΔH = ΔH1+ΔH2
D.氯原子没有改变O3分解反应的历程
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省邯郸市高一上第一次月考化学试卷(解析版) 题型:实验题
(10分)实验室里要配制465 mL 0.2 mol/L的硫酸钠溶液。
(1)请填写下列空白:
A.计算、称量、溶【解析】
在天平上称出________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。
B.转移:把得到的溶液冷却后小心地沿着________注入________中。
C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm ,改用________小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
E.摇匀:将瓶塞塞紧,充分摇匀。
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(2)下列情况会使所配溶液浓度偏高的是________(填字母)。
a.某同学定容时俯时容量瓶刻度线
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线又加水了
d.进行B操作时将少量液体洒到外面
e.未冷却至室温就进行转移
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一上10月月考化学试卷(解析版) 题型:选择题
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abcd D.acd
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期四调考试化学试卷(解析版) 题型:选择题
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,正确的是
(甲)AO3n-+Xn-+H+→X单质+H2O(未配平);(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A.④⑤ B.①③ C.②③ D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com