
【题目】苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。
反应原理:
实验步骤:
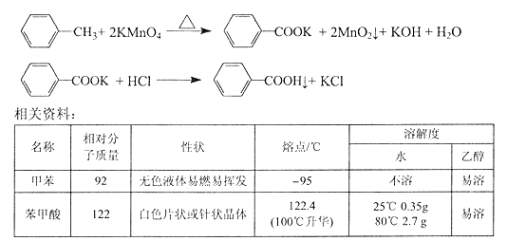
①下图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/ mL)。
![]()
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)仪器a名称为 。
(2)判断甲苯己完全反应的现象是 、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是 ;苯甲酸粗产品除了可用重结晶法精制外,还可用 法。
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52 mL.V3= 23.80mL。
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是 。
②若用酚酞作指示剂,确定滴定终点的现象是 。
③产品的纯度为 。
【答案】(1)(蛇形)冷凝管
(2)三颈烧瓶中混合液不再分层(或甲苯层消失)
(3)减少苯甲酸因溶解造成损失,升华
(4)①常温下苯甲酸微溶于水而易溶于乙醇
②滴加最后一滴氢氧化钠标准溶液后,溶液由无色变为浅红色,且30秒不褪色
③90%
【解析】
试题分析:(1)用于冷凝回流的仪器a名称是(蛇形)冷凝管;
(2)反应中得到苯甲酸钾,而苯甲酸钾溶于水,甲苯不溶于水,完全反应时:三颈烧瓶内溶液不分层、回流液不再出现油珠;
(3)温度较高时,苯甲酸溶解度增大,用少量冷水洗涤可以减少苯甲酸因溶解造成的损失;由表中数据可知,苯甲酸具有升华性质,可以利用升华法进行提纯;
(4)①由表中数据可知,常温下苯甲酸微溶于水而易溶于乙醇,故配制溶液时用稀乙醇而不用蒸馏水作溶剂;
②反应到达终点时,加入最后一滴NaOH溶液,溶液由无色变为浅红色,且30s不褪色;
③第三次与前两次消耗氢氧化钠的体积相差较大,应舍弃,消耗氢氧化钠溶液的体积为![]() =22.50mL,苯甲酸与氢氧化钠按1:1反应,则n(苯甲酸)=n(NaOH)=0.1000molL-1 ×0.02250L=0.002250mol,则其总质量为0.002250mol×122g/mol×
=22.50mL,苯甲酸与氢氧化钠按1:1反应,则n(苯甲酸)=n(NaOH)=0.1000molL-1 ×0.02250L=0.002250mol,则其总质量为0.002250mol×122g/mol×![]() =1.098g,所以产品中苯甲酸质量分数为
=1.098g,所以产品中苯甲酸质量分数为![]() ×100%=90.0%。
×100%=90.0%。


科目:高中化学 来源: 题型:
【题目】金属活动性的强弱与人类开发利用这些金属单质的时间顺序有着某种内在联系。由此推断,下列金属中人类开发利用最早的是:
A.Cu B.Fe C.Zn D.Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空: ,
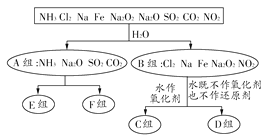
(1)上述第一级分类标准(分成A、B组所依据)是______。
(2)C组物质为______________(填化学式)。
(3)D组物质中,与水反应时氧化剂和还原剂的物质的量之比为1:1的物质是_________(填化学式)。
(4)若E组和F组均有两种物质,则其分类依据是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法中,正确的是( )。
A.化学反应速率是指某一时刻、某种反应物的瞬时反应速率
B.化学反应速率为0.8 mol·L-1·s-1指反应1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以推知化学反应的快慢
D.对于一个化学反应来说,其反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):

根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH>0,T1>T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1
D.反应Ⅳ:ΔH<0,T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中,能够表明反应A(s)+3B(g)![]() 2C(g)+D(g)已达平衡的是( )
2C(g)+D(g)已达平衡的是( )
①混合气体的压强不变;
②混合气体的密度不变;
③B的物质的量浓度不变;
④容器内B、C、D三种气体的浓度比为3:2:1;
⑤混合气体的相对分子质量不变;
⑥消耗3molB的同时生成2molC
A.①②③ B.②③④ C.②③⑤ D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验能成功的是
A.将卤代烃和氢氧化钠溶液混合加热,充分反应后再加入硝酸银溶液观察沉淀的颜色判断卤素原子
B.将铁屑、溴水、苯混合制溴苯
C.在苯酚溶液中滴入少量稀溴水出现白色沉淀
D.将铜丝在酒精灯上加热变黑后,立即深入无水乙醇中,铜丝恢复成原来的红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:光导纤维的主要成分是 ;目前应用最多的太阳能电池的光电转化材料是 ;
(2)某气态氧化物的化学式为XO2,在标准状况下,1.92 g 该氧化物的体积为672 mL,则该氧化物的摩尔质量为 _____。
(3)某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验:
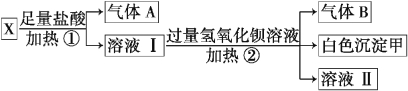
(1)白色沉淀甲是________。
(2)试写出实验过程中生成气体B的离子方程式 _________________________。
(3)通过上述实验,可确定X溶液中一定存在的离子是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用氨的催化氧化制备硝酸,起反应如下:
![]()
![]()
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为 (用小数表示,保留2位小数)
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为 (用小数表示,保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液为 吨
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
![]() ①
①
![]() ②
②
若每生产1mol CO2,吸收溶液质量就增加40g。计算吸收液中NaNO2和NaNO3物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com