
【题目】恒温恒容密闭容器中,能够表明反应A(s)+3B(g)![]() 2C(g)+D(g)已达平衡的是( )
2C(g)+D(g)已达平衡的是( )
①混合气体的压强不变;
②混合气体的密度不变;
③B的物质的量浓度不变;
④容器内B、C、D三种气体的浓度比为3:2:1;
⑤混合气体的相对分子质量不变;
⑥消耗3molB的同时生成2molC
A.①②③ B.②③④ C.②③⑤ D.①③⑥
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯和甲烷都能发生加成反应
B.米酒变酸是因为乙醇被氧化为乙酸
C.糖类、油脂、蛋白质都属于天然高分子化合物
D.可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)多硫化钠Na2Sx(x≥2)在NaOH溶液中可被NaClO氧化成Na2SO4,而NaClO被还原为NaCl,请写出该反应的化学方程式 。
(2)某一反应体系中有反应物和生成物共6种:HC1、H2SO4、SnC12、SnC14、FeSO4、Fe2(SO4)3,反应前在溶液中滴加KSCN溶液显红色,反应后红色消失。
①该反应的氧化剂是 。
②在该反应中,发生氧化反应的过程是 → 。
③写出该反应的化学方程式,并标出电子转移的方向和数目: 。
④SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和Hg2C12(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C4H6O2,下列说法不正确的是
A.可能含有一个酯基和一个碳碳双键
B.可能含有一个醛基和一个羰基
C.可能含有一个环和一个酯基
D.可能含有一个醛基和一个碳碳叁键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。
反应原理:
实验步骤:
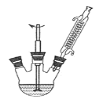
①下图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/ mL)。
![]()
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)仪器a名称为 。
(2)判断甲苯己完全反应的现象是 、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是 ;苯甲酸粗产品除了可用重结晶法精制外,还可用 法。
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52 mL.V3= 23.80mL。
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是 。
②若用酚酞作指示剂,确定滴定终点的现象是 。
③产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为 C5H10O2 并能与饱和 NaHCO3 溶液反应放出气体的有机物有 (不含立体异构)
A.3 种 B.4 种 C.5 种 D.6 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2A(g)+3B(g)![]() 2C(g)+zD(g),现将2mol A与3mol B混合于2 L的恒容密闭容器中,若反应进行2 s,A的转化率为40%,测得v(D)=0.2 mol·L-1·S-1,下列有关该反应的说法错误的是( )
2C(g)+zD(g),现将2mol A与3mol B混合于2 L的恒容密闭容器中,若反应进行2 s,A的转化率为40%,测得v(D)=0.2 mol·L-1·S-1,下列有关该反应的说法错误的是( )
A.z=2
B.2s末,反应物B的浓度为0.9mol·L-1
C.若反应再经2s达平衡,则平衡时生成物D的浓度为0.8mol·L-1
D.反应达平衡时,反应物A、B的分子数之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
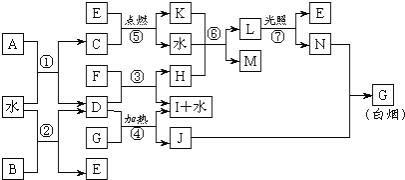
请按要求填空:
(1)I的电子式是_ __;
(2)反应⑥的化学方程式是 ,反应③在工业上的一个重要用途是 _;
(3)反应④的化学方程式是__ _;
(4)根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料﹣纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4
+NH4HSO4
(苯乙腈)
![]() +Cu(OH)2→(
+Cu(OH)2→(![]() )2Cu+H2O
)2Cu+H2O
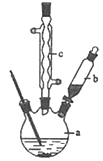
制备苯乙酸的装置示意图如图(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇.
回答下列问题:
(1)在250mL三口瓶a中加入70mL 70%硫酸.配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 .
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应.在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 .反应结束后加适量冷水,再分离出苯乙酸粗品.加入冷水的目的是 ,下列仪器中可用于分离苯乙酸粗品的是 (填标号)
A、分液漏斗
B、漏斗
C、烧杯
D、直形冷凝管
E、玻璃棒
(3)提纯苯乙酸的方法是重结晶,最终得到44g纯品,则苯乙酸的产率是 .(百分数)
(4)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com