
【题目】已知4NH3(g)+5O2 (g)=4NO(g) + 6H2O (g) ,若化学反应速率分别用v (NH3)、v (O2 )、v(NO)、v (H2O)[单位:mol/ ( L s)] 表示,则正确的关系是
A.![]() v(NH3)=v (O2)B.
v(NH3)=v (O2)B.![]() v (O2) =v(H2O)
v (O2) =v(H2O)
C.v(NH3)=![]() v(H2O)D.v(O2) =
v(H2O)D.v(O2) =![]() v(NO)
v(NO)
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
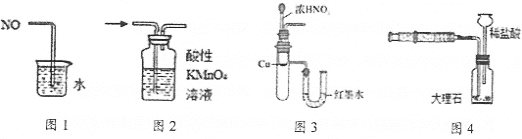
A.图1可用于吸收多余的NO
B.图2可用于检验SO2的漂白性
C.图3可用于说明铜与浓硝酸反应的能量变化
D.图4可用于测定CO2的生成速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。

一种生成Na2FeO4的反应如下:Fe2O3+Na2O2(氧为-1价)![]() Na2FeO4+Na2O(未配平),下列说法不正确的是( )
Na2FeO4+Na2O(未配平),下列说法不正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中失去电子
C.配平后为Fe2O3+3Na2O2=2Na2FeO4+Na2O
D.Na2FeO4能消毒杀菌是因其具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题(Cl2易溶于CCl4)。
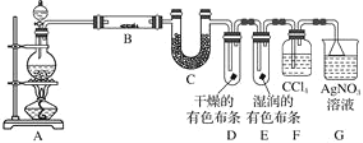
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2质量总是小于3.55 g的原因是________________________________。
(2)①装置B中盛放的试剂名称为________________,作用是________________________________,现象是_____________________________。
②装置D和E中出现的不同现象说明的问题是___________________。
③装置F的作用是__________________________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
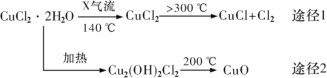
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素X、Y、Z、W的原子序数依次增加,且均不大于20,X的单质是手机电池重要的电极材料;常温下,Y的两种气态氧化物之间可发生可逆反应;X、Y、W最外层电子数之和与Z的最外层电子数相等;W能形成多种氧化物。下列说法正确的是
A.常温下,Z的单质与Y的简单氢化物相遇,可能产生白烟
B.Z非金属性强于Y,其对应含氧酸的酸性:Z>Y
C.原子半径:X>Y;简单离子半径:Z<W
D.X、W的单质均为活泼金属,通常保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,0.1 mol·L-1HA溶液中 =108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
=108,0.01 mol·L-1BOH溶液pH=12。请回答下列问题:
(1)HA的电离常数Ka为________,BOH是________(填“强电解质”或“弱电解质”)。
(2)pH相等的BOH溶液与BA溶液,分别加热到相同的温度后BOH溶液的pH________(填“>”“=”或“<”)BA溶液的pH。
(3)已知碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11,向等浓度的Na2CO3和NaA的溶液中滴加盐酸直至过量,则与H+作用的粒子依次为___________________。
(4)25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________。
②0.10 mol·L-1 NaHSO3溶液中离子浓度由大到小的顺序为_____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com