
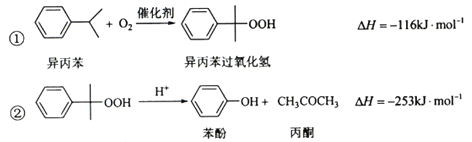
【题目】(化学——选修2:化学与技术)苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
相关化合物的物理常数
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)。
a. NaOH b. CaCO c. NaHCO d. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
【答案】(1)氧气(或空气)
(2)A;C
(3)催化剂(提高反应速率);腐蚀设备
(4)放热;可能会导致(过氧化物)爆炸
(5)c
(6)丙酮、苯酚;苯酚的沸点高于丙酮
(7)原子利用率高
【解析】
(1)异丙苯被氧气氧化为异丙苯过氧化氢,异丙苯过氧化氢在酸性溶液中分解即可得到苯酚和丙酮,因此在反应器A中通入的X是氧气或空气。
(2)根据流程图可知反应①和②分别在装置A和C中进行。
(3)异丙苯过氧化氢在酸性溶液中分解,所以浓硫酸的作用是作催化剂。由于浓硫酸具有酸性,因此缺点是容易腐蚀设备。
(4)△H小于0,则反应②为放热反应。反应温度控制在50-60℃,由于过氧化物受热易分解,因此温度过高的安全隐患是容易发生爆炸。
(5)苯酚与碳酸氢钠不反应,所以选择碳酸氢钠。
(6)由于苯酚的沸点高于丙酮,丙酮先气化,所以蒸馏塔F中的馏出物T和P分别为丙酮和苯酚。
(7)根据以上分析可知用该方法合成苯酚和丙酮的优点是原子利用率高、没有副产物。


科目:高中化学 来源: 题型:
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
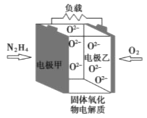
A.电池内的O2—由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的装置中,烧瓶中充满干燥气体a,然后打开弹簧夹f,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,烧瓶中的液体d呈喷泉喷出,最终几乎充满烧瓶。下列各组不可能出现上述现象的是
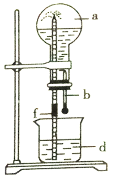
序号 | a(干燥气体) | b(液体)与d(液体) |
A | NO | 水 |
B | CO2 | 4mol·L-1NaOH溶液 |
C | Cl2 | 4mol·L-1NaOH溶液 |
D | NH3 | 1mol·L-1盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____gcm-3。
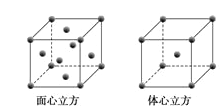
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN![]() N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将___________能转化为__________能。其电极反应式分别为:负极_________________,正极____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__________________________________________________。
②让反应停止的操作方法及原因是_______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填字母)。
a. b.
b.![]() c.
c. d.
d.![]() e.
e.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)CO泄漏会导致人体中毒,用于检测CO的传感器的工作原理如图所示:写出电极I上发生的反应式:__。

工作一段时间后溶液中H2SO4的浓度__(填“变大”、“变小”或“不变”)
(2)用O2氧化HCl制取Cl2,可提高效益,减少污染。反应为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) H,通过控制条件,分两步循环进行,可使HCl转化率接近100%,其原理如图所示:
2Cl2(g)+2H2O(g) H,通过控制条件,分两步循环进行,可使HCl转化率接近100%,其原理如图所示:
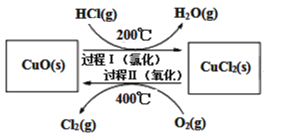
过程I的反应为:2HCl(g)+CuO(s)![]() CuCl2(s)+H2O(g) H1
CuCl2(s)+H2O(g) H1
过程II反应的热化学方程式(H2用含有H和H1的代数式表示)__。
(3)在温度T0℃,容积为1L的绝热容器中,充入0.2molNO2,发生反应:2NO2(g)![]() N2O4(g) H<0,容器中NO2的相关量随时间变化如图所示。
N2O4(g) H<0,容器中NO2的相关量随时间变化如图所示。
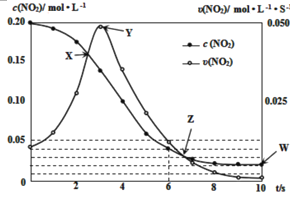
①反应到6s时,NO2的转化率是__。
②根据图示,以下各点表示反应达到平衡状态的是__。
a.X b.Y c.Z d.W
③0~3s内容器中NO2的反应速率增大,而3s后容器中NO2的反应速率减小了,原因是__。
④此容器中反应达平衡时,温度若为T1℃,此温度下的平衡常数K═__。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1molL-1的Na2SO3溶液吸收SO2,当溶液pH═7时,溶液中各离子浓度的大小关系为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)═c(OH-)。(已知25℃时:H2SO3的电离常数Ka1═1.3×10-2,Ka2═6.2×10-8)请结合所学理论通过计算说明c(HSO3-)>c(SO32-)的原因___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com