
【题目】治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)CO泄漏会导致人体中毒,用于检测CO的传感器的工作原理如图所示:写出电极I上发生的反应式:__。

工作一段时间后溶液中H2SO4的浓度__(填“变大”、“变小”或“不变”)
(2)用O2氧化HCl制取Cl2,可提高效益,减少污染。反应为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) H,通过控制条件,分两步循环进行,可使HCl转化率接近100%,其原理如图所示:
2Cl2(g)+2H2O(g) H,通过控制条件,分两步循环进行,可使HCl转化率接近100%,其原理如图所示:
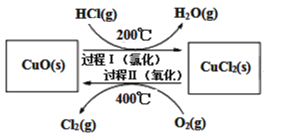
过程I的反应为:2HCl(g)+CuO(s)![]() CuCl2(s)+H2O(g) H1
CuCl2(s)+H2O(g) H1
过程II反应的热化学方程式(H2用含有H和H1的代数式表示)__。
(3)在温度T0℃,容积为1L的绝热容器中,充入0.2molNO2,发生反应:2NO2(g)![]() N2O4(g) H<0,容器中NO2的相关量随时间变化如图所示。
N2O4(g) H<0,容器中NO2的相关量随时间变化如图所示。
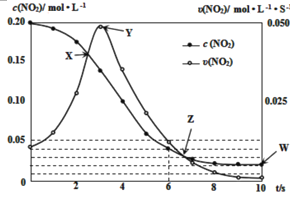
①反应到6s时,NO2的转化率是__。
②根据图示,以下各点表示反应达到平衡状态的是__。
a.X b.Y c.Z d.W
③0~3s内容器中NO2的反应速率增大,而3s后容器中NO2的反应速率减小了,原因是__。
④此容器中反应达平衡时,温度若为T1℃,此温度下的平衡常数K═__。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1molL-1的Na2SO3溶液吸收SO2,当溶液pH═7时,溶液中各离子浓度的大小关系为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)═c(OH-)。(已知25℃时:H2SO3的电离常数Ka1═1.3×10-2,Ka2═6.2×10-8)请结合所学理论通过计算说明c(HSO3-)>c(SO32-)的原因___。
【答案】CO-2e-+H2O=CO2+2H+ 不变 2CuCl2(s)+O2(g)═2CuO(s)+2Cl2(g) H2═H-2H1 80% d 反应放热,体系的温度升高,反应速率加快,后来NO2浓度减小,反应速率随之减小 225 根据Ka2═c(SO32-)c(H+)/c(HSO3-)=6.2×10-8,将c(H+)═1.0×10-7代入得出c(SO32-)/c(HSO3-)═6.2×10-1<1,所以c(HSO3-)>c(SO32-)
【解析】
(1)根据图示可知电极I上CO失电子被氧化为CO2,电解质溶液为硫酸溶液,所以电极方程式为CO-2e-+H2O=CO2+2H+;电极Ⅱ上氧气被还原生成水,电极方程式为O2+4e-+4H+=2H2O,所以总反应为2CO+O2=2CO2,不影响硫酸的浓度,即硫酸的浓度不变;
(2)总反应为4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) H ①;
2Cl2(g)+2H2O(g) H ①;
过程I的反应为:2HCl(g)+CuO(s)![]() CuCl2(s)+H2O(g) H1 ②;
CuCl2(s)+H2O(g) H1 ②;
根据盖斯定律①-②×2可得过程II反应的热化学方程式为2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g) H2=H-2H1,因整个过程中HCl的转化率接近100%,所以过程II用“=”;
(3)①据图可知6s时,c(NO2)=0.05mol/L,初始c(NO2)=0.20mol/L,所以转化率为![]() =80%;
=80%;
②据图可知X、Y、Z三个点速率还在随时间发生改变,W点速率不在改变,所以W点可以表示反应达到平衡状态,所以选d;
③该反应放热,随反应进行体系内温度升高,反应速率加快,但后来NO2的浓度减小,浓度对反应速率的影响占主导,所以反应速率减慢;
④据图可知平衡时c(NO2)=0.02mol/L,则△c(NO2)=0.20mol-0.02mol/L=0.18mol/L,根据方程式可知平衡时c(N2O4)=0.09mol/L,所以平衡常数K=![]() =225;
=225;
(4)根据Ka2=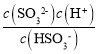 =6.2×10-8,将c(H+)=1.0×10-7代入得出
=6.2×10-8,将c(H+)=1.0×10-7代入得出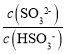 =6.2×10-1<1,所以c(HSO3-)>c(SO32-)。
=6.2×10-1<1,所以c(HSO3-)>c(SO32-)。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】(化学——选修2:化学与技术)苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
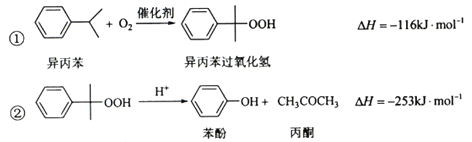
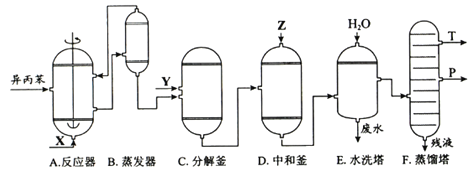
相关化合物的物理常数
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)。
a. NaOH b. CaCO c. NaHCO d. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属组成的合金A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:
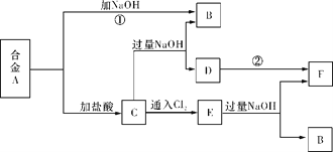
(1)溶液C的溶质主要是____________________(填化学式)。
(2)写出反应②的化学方程式_______________________________________________。描述D变F的实验现象_______________________________________________。
(3)写出反应C→E的离子方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g) ![]() B(g)+2C(g)为放热反应,下列有关说法错误的是( )
B(g)+2C(g)为放热反应,下列有关说法错误的是( )
A. 该反应属于可逆反应B. A可以完全转化为B和C
C. 化学变化伴随能量变化D. 2molA比2molC的总能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的原子序数依次递增。已知:①
五种元素的原子序数依次递增。已知:①![]() 位于周期表中第四周期
位于周期表中第四周期![]() 族,其余的均为短周期主族元素:②
族,其余的均为短周期主族元素:②![]() 的氧化物是光导纤维的主要成分;③
的氧化物是光导纤维的主要成分;③![]() 原子核外
原子核外![]() 层电子数为奇数;④
层电子数为奇数;④![]() 是形成化合物种类最多的元素;⑤
是形成化合物种类最多的元素;⑤![]() 原子
原子![]() 轨道的电子数为4。请回答下列问题:
轨道的电子数为4。请回答下列问题:
(1)写出一种![]() 元素形成氢化物的化学式_____________。
元素形成氢化物的化学式_____________。
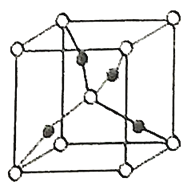
(2)在1个由![]() 与
与![]() 形成的
形成的![]() 晶胞中(结构如图所示)所包含的
晶胞中(结构如图所示)所包含的![]() 原子数目为____________个。
原子数目为____________个。
(3)在[F(NH3)4]2+离子中,![]() 的空轨道接受
的空轨道接受![]() 的氮原子提供的__________形成配位键。
的氮原子提供的__________形成配位键。
(4)常温下![]() 、
、![]() 和氢元素按原子数目1:1:2形成的气态常见物质
和氢元素按原子数目1:1:2形成的气态常见物质![]() 是__________(写名称),
是__________(写名称),![]() 物质分子中
物质分子中![]() 原子轨道的杂化类型为__________,
原子轨道的杂化类型为__________,![]() 分子中
分子中![]() 键的数目为__________
键的数目为__________![]() 。
。
(5)![]() 、
、![]() 、
、![]() 三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,工艺流程如下: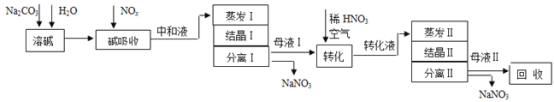
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)中和液所含溶质除NaNO2及少量Na2CO3外,还有__________(填化学式)。
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是_______。蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的_______(填操作名称)最合理。
(3)母液Ⅰ进行转化时加入稀HNO3的目的是_______。母液Ⅱ需回收利用,下列处理方法合理的是________。
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液 d.转入结晶Ⅱ操作
(4)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38吨NaNO2时,Na2CO3的理论用量为______吨(假定Na2CO3恰好完全反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A. ①④⑥B. ①②④C. ②③⑤D. ③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com