
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__________________________________________________。
②让反应停止的操作方法及原因是_______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填字母)。
a. b.
b.![]() c.
c. d.
d.![]() e.
e.![]()
【答案】3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑ CD 2NO+O2=2NO2 接收被气体压出U形管的液体,防止稀硝酸溢出 关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止 cd
【解析】
(1)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮以及水;
(2)①铁、铝的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应;
②NO容易被空气中的氧气氧化为红棕色的NO2气体;
(3)①一氧化氮是难溶于水的气体,生成的气体导致U形管右端气体压强增大,把U形管的液体压入长玻璃管;
②关闭U形管右端导气管上的活塞,反应产生的气体导致U形管右端气体压强增大,将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开;
(4)NO能与O2反应,不能用排空气法收集,NO难溶于水,可用排水法收集。
(1)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮以及水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(2)①实验室若没有铜丝,以铜粒代替铜丝进行实验,包裹铜粒的丝状材料不能是金属铁以及金属铝,因为铁、铝的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应,故答案为:CD;
②试管内有空气,NO容易被空气中的氧气氧化为红棕色的NO2气体,反应的化学方程式为2NO+O2═2NO2;
(3)①一氧化氮是难溶于水的气体,当制取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,生成的气体导致U形管右端气体压强增大,把U形管的液体压入长玻璃管,所以长玻璃管的作用是接收被气体压出U形管的液体,防止稀硝酸溢出,故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出;
②关闭U形管右端导气管上的活塞,反应产生的气体导致U形管右端气体压强增大,将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止,故答案为:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)NO能与O2反应,不能用排空气法收集,NO难溶于水,可用排水法收集,故cd正确。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
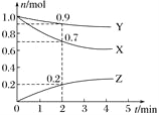
A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质。它们之间有如下转化关系:
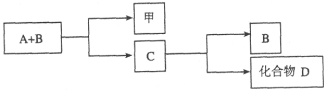
化合物D也是生活中常见的化合物,在一定条件下可发生如下反应:D+3甲![]() 3A+2B
3A+2B
请回答下列问题:
(1)在化合物A、B、C、D中所含元素完全相同的是__________和__________(填字母)。
(2)在常温下,A和B通过__________转化为C。该过程的能量转化关系如何?
____________________。
(3)写出由C生成D的反应的化学方程式____________________。
(4)化合物C是人类生命活动不可缺少的物质之一,它在血液中的正常含量是__________。
(5)目前化合物B在大气中含量呈上升趋势,对环境造成的影响是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均含有某种常见元素,A、G为非金属单质,A常温下为褐色固体,G为空气的主要成分之一;D常温下为无色液体,C、E常温下均为无色气体,E是形成酸雨的元凶,相对分子质量是G的2倍;常温下F为淡黄色固体。它们的转化关系如图所示(部分产物已略去)。

(1)写出B物质的化学式_________________。
(2)气体E能够使品红溶液褪色,说明它具有____________性。
(3)写出反应①的化学方程式_______________________________________。
(4)写出反应②的化学方程式_______________________________________。
(5)简述B溶液中阴离子检验方法________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁、移动支付、共享单车、网购,被称为中国“新四大发明”。用于高铁和共享单车制造业的重要金属材料是( )

A.Na﹣K合金B.Cu﹣Sn合金C.Sn﹣Pb合金D.Mg﹣Al合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗;⑩胶头滴管。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液;⑤蒸馏水。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是____;
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是____;
(3)过滤时,应选用上述玻璃仪器中的____(填编号)。
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在___(填“酸式或碱式滴定管”)中,达到滴定终点的现象为____。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度___(填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为__mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
反应 II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反应 III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
(1)请写出煤基合成气[n(CO):n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式:__,该反应在较低温条件下能自发进行,则ΔH___0(填“>”、“<”或“=”)。
(2)一定温度下,在2L的密闭容器中投入物质的量均为0.4mol的CO和CH3ONO发生反应II,10min达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是____。
a.CO的质量不再变化
b.混合气体的密度不再变化
c.单位时间内生成CO和NO的物质的量相等
d.CO和CH3ONO的浓度比不再变化
②若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比__(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____(填字母)。
a.  b.
b. 
c.  d.
d. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com