
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1
反应 II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反应 III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3=c kJ·mol-1
(1)请写出煤基合成气[n(CO):n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式:__,该反应在较低温条件下能自发进行,则ΔH___0(填“>”、“<”或“=”)。
(2)一定温度下,在2L的密闭容器中投入物质的量均为0.4mol的CO和CH3ONO发生反应II,10min达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是____。
a.CO的质量不再变化
b.混合气体的密度不再变化
c.单位时间内生成CO和NO的物质的量相等
d.CO和CH3ONO的浓度比不再变化
②若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比__(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____(填字母)。
a.  b.
b. 
c.  d.
d. 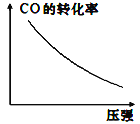
【答案】4H2(g)+2CO(g)+![]() O2(g)
O2(g)![]() HOCH2CH2OH(l)+H2O(g) △H3=(
HOCH2CH2OH(l)+H2O(g) △H3=(![]() a+b+c)kJ·mol-1 < abc 增大 b
a+b+c)kJ·mol-1 < abc 增大 b
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得待求的反应的热好方程式。根据反应自发进行的判断依据分析反应热ΔH与0的大小;
(2)①根据可逆反应平衡状态的特征判断;
②根据勒夏特列原理分析,改变平衡移动的条件,平衡向减弱这个因素的方向移动,但不可能完全消除;
③根据影响平衡的移动因素并结合图象分析判断。
(1)已知反应 I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1、反应II:2CO(g)+2CH3ONO(g)
4CH3ONO(g)+2H2O(g) △H1 =akJ·mol-1、反应II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1、反应III:CH3OOCCOOCH3(1)+4H2(g)
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1、反应III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g) △H3=ckJ·mol-1,根据盖斯定律,由I×+Ⅱ+Ⅲ得反应4H2(g)+2CO(g)+
HOCH2CH2OH(1)+2CH3OH(g) △H3=ckJ·mol-1,根据盖斯定律,由I×+Ⅱ+Ⅲ得反应4H2(g)+2CO(g)+![]() O2(g)
O2(g)![]() HOCH2CH2OH(l)+H2O(g) △H3=(
HOCH2CH2OH(l)+H2O(g) △H3=(![]() a+b+c)kJ·mol-1,则△H3=(
a+b+c)kJ·mol-1,则△H3=(![]() a+b+c)kJ·mol-1;该反应为熵减的反应,即△S<0,已知该反应在较低温条件下能自发进行,要使△G=△H-T△S<0,必须△H<0;
a+b+c)kJ·mol-1;该反应为熵减的反应,即△S<0,已知该反应在较低温条件下能自发进行,要使△G=△H-T△S<0,必须△H<0;
(2)①a.CO的质量不再变化,说明反应已达到平衡状态,a符合题意;
b.该反应在恒容条件下进行,且参与物质不完全为气体,气体的密度为变量,当混合气体的密度不再变化,说明反应已达平衡状态,b符合题意;
c.CO和NO一种是反应物,一种是生成物,若单位时间内生成CO和NO的物质的量相等,说明正逆反应速率相等,反应达到平衡状态,c符合题意;
d.CO和CH3ONO的投料相等且在反应中计量数相等,因此两者的浓度比始终不变,不能据此作为平衡状态的判断依据,d不符合题意;
故合理选项为abc;
②若此时向容器中再通入0.4 mol NO,NO的体积分数增大,平衡逆向移动,但平衡移动的趋势是微弱的,根据勒夏特列原理可知,重新平衡时 NO的体积分数与原平衡时相比增大;
③a.该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,a错误;
b.平衡常数只与温度有关,与反应的物质的物质的量及浓度无关,故NO的物质的量变化,K值保持不变,b正确;
c.该反应为放热反应,升高温度平衡逆向移动,NO的体积分数减小,c错误;
d.该反应为气体体积缩小的反应,增大压强,平衡正向移动,CO的转化率增大,d错误;
故合理选项是b。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__________________________________________________。
②让反应停止的操作方法及原因是_______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填字母)。
a. b.
b.![]() c.
c. d.
d.![]() e.
e.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,其中A为常见金属, C为碱。试回答:
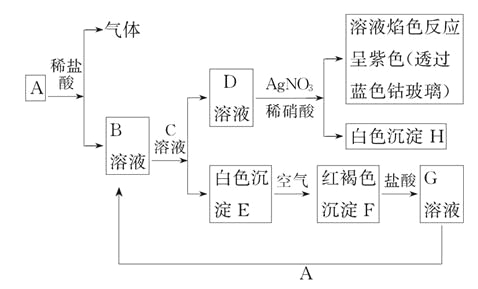
(1)写出E的化学式__________,H的化学式___________。
(2)写出由E转变成F的化学方程式:______________________。
(3)向G溶液加入A的有关离子反应方程式:__________________。
(4)写出A在一定条件下与水反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为实验装置。

(1)写出下列仪器的名称:a._____________________ b. __________________
(2)若利用此装置分离四氯化碳和酒精的混合物,还缺少的仪器是 ________ ,将仪器补充完整后进行实验,温度计水银球的位置在______________处。冷凝水由__________(填f或g) 口通入,_____ 口流出。
(3)进行蒸馏操作时,需在a装置中加入__________________,目的_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)![]() pC(g)+qD(g)。
pC(g)+qD(g)。
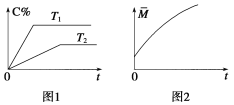
(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质________mol。
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图1所示。则T1(填“>”、“<”或“=”)______T2,该反应正反应方向的ΔH(填“>”、“<”或“=”)______0。
(3)一定条件下,从正反应开始至达到化学平衡的过程中,混合气体的平均相对分子质量随时间的变化如图2所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)__________。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致酸雨形成的是________(填字母,下同)。
a. CH4 b. CO c. SO2
②下列处理废水的方法属于中和法的是________。
a. 用熟石灰处理废水中的酸
b. 用臭氧处理废水中的氰化物
c. 用铁粉回收废水中的铜
③下列做法会造成土壤重金属污染的是________。
a. 作物秸杆露天焚烧
b. 废干电池就地填埋
c. 废旧塑料随意丢弃
(2)新鲜牛肉含蛋白质、脂肪、糖类、维生素A、维生素C、钙、铁等,其中:
①属于人体所需微量元素的是________。
②属于脂溶性维生素的是________。
③可为人体提供能量的是________、________和________。
(3)材料的发展与应用促进了人类社会的进步。
①碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是________;属于硅酸盐材料的是________;属于高分子材料的是挤塑板和________。

②吸附材料具有多孔、表面积大的特点。活性炭吸附NO2的过程中,会伴有C与NO2的反应,产物为两种常见无毒气体。写出该反应的化学方程式:_________________________________________。
③LiMn2O4是锂离子电池的一种正极材料,可通过MnO2与Li2CO3煅烧制备,同时还生成CO2和一种单质。写出该反应的化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:

已知:![]() ,根据以上的实验操作和现象,该同学得出的结论不正确的是
,根据以上的实验操作和现象,该同学得出的结论不正确的是![]()
A.试样中肯定存在![]() 、
、![]() 、
、![]() 和
和![]()
B.试样中一定不含![]()
C.试样中可能存在![]() 、
、![]()
D.该雾霾中可能存在![]() 、
、![]() 和
和![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com