
【题目】Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗;⑩胶头滴管。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液;⑤蒸馏水。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是____;
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是____;
(3)过滤时,应选用上述玻璃仪器中的____(填编号)。
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在___(填“酸式或碱式滴定管”)中,达到滴定终点的现象为____。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度___(填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为__mol/L。
【答案】指示剂 250mL容量瓶 ④⑤⑨ 酸式滴定管 当滴加最后一滴KMnO4溶液时,锥形瓶中溶液从无色变为浅紫色,且半分钟内不变色 偏高 0.1c(b-a)
【解析】
I.(1)做酸碱中和滴定时,还缺少的试剂是酸碱指示剂,来判断反应是否达到滴定终点;
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是用于配制溶液的250mL的容量瓶;
(3)过滤操作,应当用漏斗组装成过滤器,用玻璃棒引流,用烧杯盛装液体,故应当选④⑤⑨;
II.(1)因为高锰酸钾是强氧化性物质,故应当使用酸式滴定管,该实验操作为使用高锰酸钾滴定草酸,故当滴加最后一滴KMnO4溶液时,锥形瓶中溶液从无色变为浅紫色,且半分钟内不变色,达到滴定终点;
(2)若滴定时,没用标准液洗涤滴定管,标准液浓度偏小,造成V(标准)偏大,根据c(待测) ![]() 分析,c(待测)偏高;
分析,c(待测)偏高;
(3)若滴定时,反应前后的两次读数分别为a和b,消耗的![]() 标准溶液体积为
标准溶液体积为![]() ,
,
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
2 5
![]()
![]()
计算得出:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH的电离常数K=1.6×10-5,该温度下向20 mL 0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题:
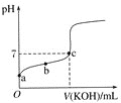
(1)a点溶液中c(H+)为____mol·L-1。
(2)b点溶液中溶质__,CH3COOH的电离常数___1.6×10-5(“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__________________________________________________。
②让反应停止的操作方法及原因是_______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填字母)。
a. b.
b.![]() c.
c. d.
d.![]() e.
e.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如表:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中,正确的是( )
A. 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B. 四种溶液中,水的电离程度最大的是NaClO
C. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D. NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
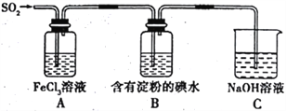
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,其中A为常见金属, C为碱。试回答:
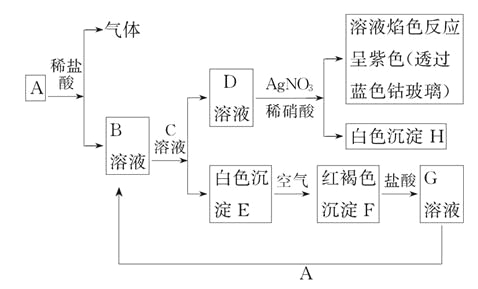
(1)写出E的化学式__________,H的化学式___________。
(2)写出由E转变成F的化学方程式:______________________。
(3)向G溶液加入A的有关离子反应方程式:__________________。
(4)写出A在一定条件下与水反应的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com