
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
【答案】将水钴矿石粉碎 ;充分搅拌;适当增加盐酸浓度;提高酸浸温度等 ![]() 将溶液中Fe2+氧化成Fe3+ Fe(OH)3、Al(OH)3 过滤 使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去 3CoC2O4+2O2
将溶液中Fe2+氧化成Fe3+ Fe(OH)3、Al(OH)3 过滤 使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去 3CoC2O4+2O2![]() Co3O4+6CO2
Co3O4+6CO2
【解析】
水钴矿中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则加入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+;加入NaClO将Fe2+氧化为Fe3+,溶液b中阳离子有Co2+、Fe3+、Al3+、Mg2+、Ca2+,加入碳酸氢钠,Fe3+、Al3+与碳酸氢根离子发生相互促进的水解反应分别生成Fe(OH)3、Al(OH)3,故沉淀A的主要成分为Fe(OH)3、Al(OH)3;溶液c中含有Co2+、Mg2+、Ca2+,加入NaF,Mg2+、Ca2+转化成MgF2、CaF2沉淀,溶液d中含有Co2+,溶液d中加入草酸铵过滤得到CoC2O4晶体,最后煅烧得到钴的氧化物,据此分析作答。
(1)“酸浸”时为固体与液体的反应,根据外界条件对化学反应速率的影响,在加入盐酸进行“酸浸”时,能够提高“酸浸”速率的方法有:将水钴矿石粉碎,增大接触面积;充分搅拌;适当增加盐酸的浓度;适当提高酸浸的温度等,故答案为:将水钴矿石粉碎;充分搅拌;适当增加盐酸浓度;提高酸浸温度等。
(2)酸浸时水钴矿中的Co2O3、Fe2O3、Al2O3、MgO、CaO溶解转化为CoCl3、FeCl3、AlCl3、MgCl2、CaCl2;加入Na2SO3,钴的存在形式为Co2+,Co3+被还原为Co2+,则SO32-被氧化成SO42-,产生Co2+的反应可表示为:SO32-+Co3+→Co2++SO42-,根据得失电子守恒配平为:SO32-+2Co3+→2Co2++SO42-,根据溶液呈酸性和电荷守恒,生成Co2+的离子方程式为SO32-+2Co3++H2O=2Co2++SO42-+2H+;
(3)加入Na2SO3还会将Fe3+还原为Fe2+,反应的离子方程式为SO32-+2Fe3++H2O=2Fe2++SO42-+2H+;溶液a中含有Co2+、Fe2+、Al3+、Mg2+、Ca2+、Na+、Cl-、SO42-等,向溶液a中加入NaClO,NaClO具有强氧化性,将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,故答案为:将溶液中Fe2+氧化成Fe3+;
(4)加入NaClO溶液后得到的溶液b中含有Co2+、Fe3+、Al3+、Mg2+、Ca2+、Na+、Cl-、SO42-等;向溶液b中加入NaHCO3调节溶液的pH,使Fe3+、Al3+转化为氢氧化物沉淀而除去,沉淀A的成分为Fe(OH)3、Al(OH)3;溶液c中含有Co2+、Mg2+、Ca2+、Na+、Cl-、SO42-等,向溶液c中加入NaF,Mg2+、Ca2转化为难溶于水的MgF2、CaF2沉淀,操作2的名称为过滤,故答案为:Fe(OH)3、Al(OH)3;过滤;
(5)根据(4)的分析,溶液c中加入NaF溶液的作用是使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去,故答案为:使Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀除去;
(6)n(CO2)=![]() =0.3mol,根据C守恒,n(CoC2O4)=0.15mol,根据Co守恒,n(Co)=0.15mol,所得钴的氧化物中n(O)=
=0.3mol,根据C守恒,n(CoC2O4)=0.15mol,根据Co守恒,n(Co)=0.15mol,所得钴的氧化物中n(O)=![]() =0.2mol,n(Co):n(O)=0.15mol:0.2mol=3:4,生成的钴的氧化物的化学式为Co3O4,在空气中煅烧CoC2O4的化学方程式为3CoC2O4+2O2
=0.2mol,n(Co):n(O)=0.15mol:0.2mol=3:4,生成的钴的氧化物的化学式为Co3O4,在空气中煅烧CoC2O4的化学方程式为3CoC2O4+2O2![]() Co3O4+6CO2。
Co3O4+6CO2。


科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示,当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是
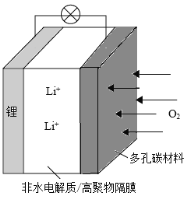
A.充电时,电解质溶液中Li+向多孔碳材料区迁移
B.充电时,电池总反应为Li2O2-x==2Li+(1-![]() )O2
)O2
C.放电时,多孔碳材料电极为负极
D.放电时,外电路电子由多孔碳材料电极流向锂电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
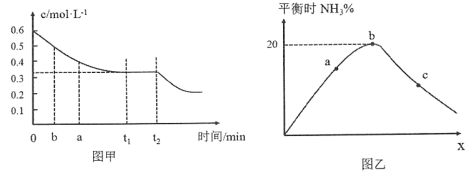
①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
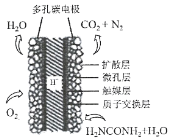
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH的电离常数K=1.6×10-5,该温度下向20 mL 0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题:
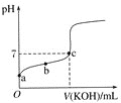
(1)a点溶液中c(H+)为____mol·L-1。
(2)b点溶液中溶质__,CH3COOH的电离常数___1.6×10-5(“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质X、Y与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:

(1)若该反应用于工业上制取粗硅,反应的化学方程式为______________
(2)若X、Y为日常生活中常见的两种金属,且甲为红棕色粉末,相应的化学方程式为_____。
(3)若X、乙的焰色反应均呈黄色,甲是一种常见的无色无味的液体,则乙物质中所含的化学键类型有_________
(4)若X是黄绿色气体,甲、乙两种气体相遇会产生白烟,则X与甲反应的化学方程式为__________。
(5)若X中的元素是海水中含量最多的金属元素,甲是相对分子质量为46且常温下能使酸性KMnO4溶液褪色的烃的含氧衍生物,则X与甲反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯中存在如下平衡:Cl2(g) Cl2(aq)、Cl2(aq)+H2O H++Cl-+HClO。下列说法正确的是( )
A.向饱和氯水中通入HCl,有c(H+)=c(Cl-)+c(OH-)+c(ClO-)
B.向氯水中滴入几滴石蕊试液,溶液变红色
C.光照后的氯水漂白性增强
D.若向饱和氯水中通入少量SO2,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中不能用化合反应的方法制得的是
①SO2 ②H2SiO3 ③Fe(OH)3 ④ Mg(OH)2 ⑤ FeCl2 ⑥CaSiO3
A.①③④⑥B.①②④C.②④⑤D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填字母)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是______________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是__________________________________________________。
②让反应停止的操作方法及原因是_______________________________________________。
(4)以下收集NO气体的装置,合理的是________(填字母)。
a. b.
b.![]() c.
c. d.
d.![]() e.
e.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com