
【题目】下列物质中不能用化合反应的方法制得的是
①SO2 ②H2SiO3 ③Fe(OH)3 ④ Mg(OH)2 ⑤ FeCl2 ⑥CaSiO3
A.①③④⑥B.①②④C.②④⑤D.②④
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+O2(g)![]() 2NO(g)在密闭容器中进行,达到平衡后,下列措施能改变化学反应速率且能使平衡发生移动的是
2NO(g)在密闭容器中进行,达到平衡后,下列措施能改变化学反应速率且能使平衡发生移动的是
A.恒容,按原平衡各物质的比例充入N2、O2和NOB.恒容,充入He
C.恒压,充入HeD.恒压,充入N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为__(填“吸热”或“放热”)反应,且m+n_(填“>”“=”或“<”)p。
(2)减压使容器体积增大时,A的质量分数__。(填“增大”“减小”或“不变”,下同)
(3)若升高温度,则平衡时B、C的浓度之比![]() 将___。
将___。
(4)若加入催化剂,平衡时气体混合物的总物质的量____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、CaO等杂质)制备钴的氧化物,其制备工艺流程如下(已知Na2SO3能还原Fe3+和Co3+):

回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写2种)。
(2)“酸浸”后加入Na2SO3钴的存在形式为Co2+,产生Co2+反应的离子方程式为________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(写化学式),操作2的名称是_______________
(5)溶液d中的金属离子只有Co2+和Na+两种,则溶液c中加入NaF溶液的作用是________
(6)在空气中缎烧CoC2O4生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05g,CO2的体积为6.72L(标准状况),则此反应的化学方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R-NO2![]() R-NH2;②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:
R-NH2;②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是______________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①②物质的结构简式:①__________,②_______。
(3)苯的二氯代物有________种同分异构体。
(4)有机物 的所有原子________(填“是”或“不是”)在同一平面上。
的所有原子________(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质。它们之间有如下转化关系:
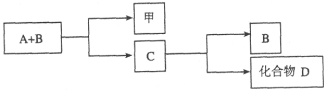
化合物D也是生活中常见的化合物,在一定条件下可发生如下反应:D+3甲![]() 3A+2B
3A+2B
请回答下列问题:
(1)在化合物A、B、C、D中所含元素完全相同的是__________和__________(填字母)。
(2)在常温下,A和B通过__________转化为C。该过程的能量转化关系如何?
____________________。
(3)写出由C生成D的反应的化学方程式____________________。
(4)化合物C是人类生命活动不可缺少的物质之一,它在血液中的正常含量是__________。
(5)目前化合物B在大气中含量呈上升趋势,对环境造成的影响是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均含有某种常见元素,A、G为非金属单质,A常温下为褐色固体,G为空气的主要成分之一;D常温下为无色液体,C、E常温下均为无色气体,E是形成酸雨的元凶,相对分子质量是G的2倍;常温下F为淡黄色固体。它们的转化关系如图所示(部分产物已略去)。

(1)写出B物质的化学式_________________。
(2)气体E能够使品红溶液褪色,说明它具有____________性。
(3)写出反应①的化学方程式_______________________________________。
(4)写出反应②的化学方程式_______________________________________。
(5)简述B溶液中阴离子检验方法________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。下列说法中,不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. 浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com