
【题目】在催化剂的作用下会发生反应:CO(g)+2H2(g)CH3OH(g)。回答下列问题:
(1)某温度下,将2molCO与5molH2的混合气体充入容积为2L 的恒容密闭容器中,经过5 min 后,反应达到平衡,此时转移 6 mol电子。从起始至平衡时v(CH3OH)=______mol·L-1·min-1,该反应的平衡常数为______L2·mol-2。
(2)在一定压强下,向容积为V L的容器中充入a molCO与2a molH2,在催化剂作用下反应生成甲醇,CO 平衡转化率与温度、压强的关系如图所示。
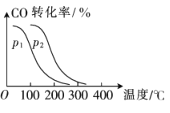
①p1____(填“>” “<”或“=”,下同)p2,△H_____0。
②下列能使该反应的化学反应速率增大,且平衡向正反应方向移动的是 __________(填字母)。
A.及时分离出CH3OH气体 B.适当升高温度
C.增大H2的浓度 D.选择高效催化剂
【答案】0.15 3 < < C
【解析】
根据电子转移的物质的量计算反应的CO的物质的量,进而计算化学反应速率,结合三段式计算化学平衡常数,由“定一议二”比较压强大小,通过温度对平衡的影响判断反应吸放热情况,根绝化学反应速率和平衡移动的影响因素进行判断。
(1)根据题干信息可知,反应CO(g)+2H2(g)CH3OH(g)中,每消耗1molCO,转移4mol电子,因此在反应达到平衡时转移6mol电子,说明从起始至平衡CO消耗了1.5mol,列三段式有:

所以 ,平衡常数
,平衡常数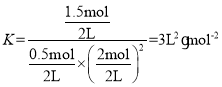 ;
;
(2)①根据图像分析,温度相同时,p1到p2的过程CO的转化率增大,说明平衡正向移动,由于该反应是气体体积减小的反应,所以p1到p2为增大压强的过程,即p1<p2;升高温度,CO的转化率减小,说明平衡逆向移动,该反应正反应为放热反应,即△H<0;
②A.及时分离除CH3OH气体平衡向正反应方向进行,但不能使化学反应速率增大,A不符合题意;
B.适当升高温度反应速率增大,但平衡向逆反应方向进行,B不符合题意;
C.增大H2的浓度能使该反应的反应速率增大,且平衡向正反应方向移动,C符合题意;
D.选择高效催化剂加快反应速率,但平衡不移动,D不符合题意;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)![]() C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
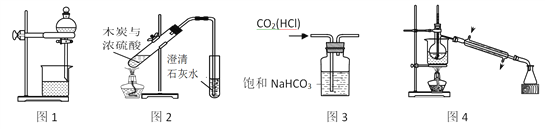
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于气相反应,用某组分(B)的平衡压强[p(B)]代替物质的量浓度(cB)也可表示平衡常数(记作Kp)。已知反应CH4(g)+2H2O(g)CO2(g)+4H2(g),在t℃时的平衡常数 Kp=a,则下列说法正确的是
A.Kp=![]()
B.升高温度,若Kp 增大,则该反应为吸热反应
C.该反应达到平衡状态后,增大压强,平衡向左移动,Kp减小
D.t℃时,反应![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)![]() CO2(g)+2H2 (g)的平衡常数Kp=
CO2(g)+2H2 (g)的平衡常数Kp=![]() a
a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在给定条件下的同分异构体数目(不包括立体异构)正确的是
A. 结构简式为![]() 的一溴代物有4种
的一溴代物有4种
B. 分子组成是C4H8O2属于酯的同分异构体有6种
C. 分子式为C4H8属于烯烃的同分异构体有4种
D. C5H12O属于醇的同分异构体有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
①![]() ②
②![]() ③
③ ④
④![]() ⑤
⑤![]()
⑥![]() ⑦
⑦ ⑧
⑧![]() ⑨
⑨![]()
请利用上述给出的物质按要求回答下列问题:
(1)③的系统命名是________。
(2)用“>”表示①③④⑧熔沸点高低顺序:________(填序号)。
(3)与③互为同系物的是________(填序号)。
(4)⑨的一氯代物同分异构体数目有________种。
(5)在120℃,![]() 条件下,某种气态烃与足量的
条件下,某种气态烃与足量的![]() 完全反应后,测得反应前后气体的体积没有发生改变,则该烃是________(填序号)。
完全反应后,测得反应前后气体的体积没有发生改变,则该烃是________(填序号)。
(6)写出⑥在铁作催化剂的条件下与液溴发生取代反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A.Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g),常压下该反应在1900℃的高温下才能进行,说明该反应的ΔH<0
B.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
C.将MgCl2·6H2O在坩埚中加热可获得MgCl2
D.反应2H2(g)+O2(g)![]() 2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
2H2O(g)的ΔH可通过下式估算:ΔH=反应中形成新共价键的键能之和反应中断裂旧共价键的键能之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
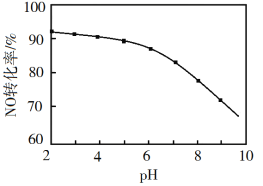
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000mol/L NaOH溶液滴定 20.00mL0.1000mol/L某一元酸HA溶液,滴定曲线如图。下列说法正确的是
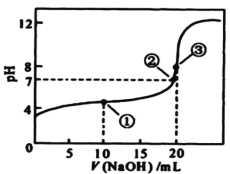
A.该滴定过程既能用甲基橙又能用酚酞作指示剂
B.点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C.点②所示溶液中:c(Na+) =c(HA) +c(A-)
D.水的电离程度随着NaOH溶液的滴入不断增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com