
【题目】工业废水中常含有一定量的 Cr2O72-和 CrO42-,它们会对生态系统产生很大的伤害,工业上对废水处理的工艺流程如下
![]()
(1)CrO4中 Cr 的化合价 ;Cr3+的核外电子排布式为 。
(2)写出第①步发生的离子反应方程式 ;若常温下,减小平衡体系的 pH 至 pH=2,则溶液趋向于显 色。
(3)第②步中,还原 0.01mol Cr2O72-离子,需要 mol 的 FeSO4·7H2O
(4)已知 Cr(OH)3 在溶液中存在以下平衡:H++CrO2-+H2O ![]() Cr(OH)3
Cr(OH)3![]() Cr3++3OH-下列有关说法中正确的是
Cr3++3OH-下列有关说法中正确的是
a.加 HCl 则平衡均向右移动,则生成 Cr3+盐
b.按照物质分类 Cr(OH)3 是两性氢氧化物,属于弱电解质
c.Cr3+盐中逐滴加入 NaOH 溶液,先产生沉淀,后沉淀消失
d.Cr(OH)3 饱和溶液中一定有 c(H )=c(OH )
【答案】(1)+6,1s22s22p63s23p63d4;
(2)2CrO42-(黄色)+2H+![]() Cr2O72-+2H2O,橙色;
Cr2O72-+2H2O,橙色;
(3)0.06mol;(4)abc。
【解析】
试题分析:(1)氧显-2价,整体显-2价,因此Cr的化合价为+6价,Cr位于第四周期VIB族元素,Cr3+的排布式为:1s22s22p63s23p63d4;(2)根据①,离子反应方程式为:2CrO42-(黄色)+2H+![]() Cr2O72-+2H2O,Cr2O72-显橙色,减小pH,增大c(H+)平衡向正反应方向移动,Cr2O72-浓度增大,即溶液显橙色;(3)根据得失电子数目守恒,有n(FeSO4·7H2O)×1=0.01×2×3,解得n(FeSO4·7H2O)=0.06mol;(4)a、加入HCl,c(H+)增大,平衡向正反应方向进行,生成Cr3+,故正确;b、根据电离方程式,既有酸式电离,又有碱式电离,说明Cr(OH)3表现两性,故正确;c、根据电离平衡,加入OH-先产生Cr(OH)3,后沉淀消失,故正确;d、溶液显碱性,c(H+)<c(OH-),故错误。
Cr2O72-+2H2O,Cr2O72-显橙色,减小pH,增大c(H+)平衡向正反应方向移动,Cr2O72-浓度增大,即溶液显橙色;(3)根据得失电子数目守恒,有n(FeSO4·7H2O)×1=0.01×2×3,解得n(FeSO4·7H2O)=0.06mol;(4)a、加入HCl,c(H+)增大,平衡向正反应方向进行,生成Cr3+,故正确;b、根据电离方程式,既有酸式电离,又有碱式电离,说明Cr(OH)3表现两性,故正确;c、根据电离平衡,加入OH-先产生Cr(OH)3,后沉淀消失,故正确;d、溶液显碱性,c(H+)<c(OH-),故错误。


科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R 为两种常见的用途广泛的金属单质,D具有磁性的黑色晶体,C是无色无味的气体,M为红褐色固体。回答相关问题
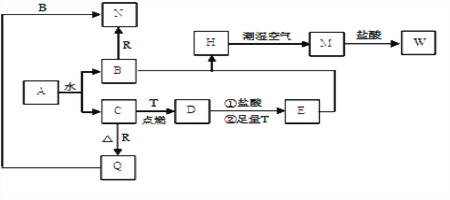
(1)写出D的化学式: ____________
(2)写出A的电子式: _____________
(3)H在潮湿空气中变为M的现象是:______________化学方程式为: ________________
(4)B与R反应的化学方程式为: __________________________
(5)向沸水中加入W饱和溶液,可制得一种红褐色透明液体,区别该液体和溶液W的简单实验方法是 ____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A有如下转化关系:
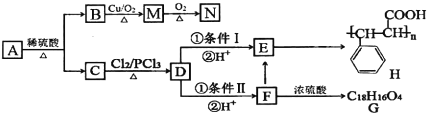
已知:①有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%。
②![]()
根据以上信息,回答下列问题:
(1)B的分子式为__________;有机物D中含氧官能团名称是__________。
(2)A的结构简式为__________;检验M中官能团的试剂是__________。
(3)条件I为__________;D→F的反应类型为__________。
(4)写出下列转化的化学方程式:
F→E___________________________,
F→G___________________________。
(5)N的同系物X比N相对分子质量大14,符合下列条件的X的同分异构体有__________种(不考虑立体异构)
①含有苯环 ②能发生银镜反应 ③遇FeCl3溶液显紫色
写出其中核磁共振氢谱有五组峰,且吸收峰的面积之比为1∶1∶2∶2∶2的同分异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式如右图: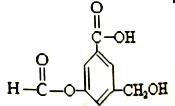
下列有关A的性质叙述中,正确的是
A. A 与金属钠完全反应时,两者反应的物质的量之比为1∶3
B. 1molA最多能与5mol氢气发生反应,反应类型是加成反应
C. 1molA与足量碳酸氢钠溶液反应,生成CO2的物质的量为2mol
D. A既能与羧基反应,又能与醇反应,还能发生水解反应和缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据题目要求回答以下问题:
(1)CuSO4·5H2O的摩尔质量是________; 0.1mol CH4含有的氢原子数为____; 0.2 mol·L-1的 AlCl3溶液中Cl—的物质的量浓度是________。
(2)现有以下物质:①NaCl ②氯水③醋酸 ④HCl ⑤酒精(C2H5OH)⑥CaCO3⑦Ba(OH)2属于强电解质的是__________,属于弱电解质的是_______。(填序号)
写出Ba(OH)2的电离方程式_________________________,
写出④与⑥反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,再逐滴加入2mol L-1的NaOH溶液至过量,所生成的沉淀与所加NaOH的关系如图所示。
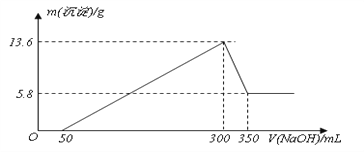
(1)0~50mL段内,发生反应的离子方程式为_________________。
(2)300~350mL段内,发生反应的离子方程式为________________。
(3)试计算该盐酸的浓度___。(写出必要的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于用CCl4萃取碘水的说法中不正确的是( )
A.碘在CCl4中的溶解度大于在水中的溶解度
B.萃取后水层颜色变浅
C.萃取后CCl4溶液层为紫色
D.萃取后水层颜色变红且在下层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
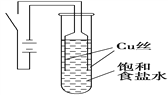
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
※ 相同温度下CuCl的溶解度大于CuOH。
下列说法错误的是( )
A. 反应结束后最终溶液呈碱性 B. 阴极上发生的电极反应为:2H2O + 2e- == H2↑+ 2OH-
C. 电解过程中氯离子移向阳极 D. 试管底部红色的固体具有还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com