
【题目】用标准盐酸测定氨水的浓度,最适宜选择的指示剂是
A. 甲基橙 B. 酚酞 C. 石蕊 D. 以上试剂均可
科目:高中化学 来源: 题型:
【题目】化学与环境保护、工业生产、生活等密切相关,下列说法不正确的是( )
A. 在食品袋中放入装有硅胶、铁粉的透气小袋,可防止食物受潮、氧化变质
B. 因SO2具有氧化性,故可用于漂白纸浆
C. 刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐
D. 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。己知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________。
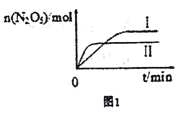
②下列有关该反应的说法正确的是________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________。
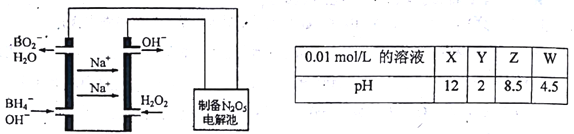
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应II达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___α1 (填“>”“<”或span>“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一恒容容器中进行如下反应 N2+3H2![]() 2NH3,下列情况一定能说明反应 已达到平衡的是( )
2NH3,下列情况一定能说明反应 已达到平衡的是( )
①容器内压强不随时间而变化
②单位时间内,有 3molH2 反应,同时有 2molNH3 生成
③气体的密度不随时间而变化
④单位时间内,有 1molN2 生成,同时有 2molNH3 生成
⑤用 N2、 H2、NH3 表示的该反应的化学反应速率之比为 1∶3∶2
⑥气体的平均摩尔质量不随时间而变化
A.①④⑥ B.①②③ C. ②③⑤ D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
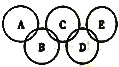
【题目】夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌、鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
(1)火焰利用了部分金属元素特征的________反应,该反应属于_________(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含的电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为![]() ,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
①B的水溶液呈弱酸性,其主要的电离方程式可表示为________________,D的化学式是_____________。
②A、B、E中均含有的一种元素为____________(填元素名称)。
③E的电子式为______________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸发生反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的 Cr2O72-和 CrO42-,它们会对生态系统产生很大的伤害,工业上对废水处理的工艺流程如下
![]()
(1)CrO4中 Cr 的化合价 ;Cr3+的核外电子排布式为 。
(2)写出第①步发生的离子反应方程式 ;若常温下,减小平衡体系的 pH 至 pH=2,则溶液趋向于显 色。
(3)第②步中,还原 0.01mol Cr2O72-离子,需要 mol 的 FeSO4·7H2O
(4)已知 Cr(OH)3 在溶液中存在以下平衡:H++CrO2-+H2O ![]() Cr(OH)3
Cr(OH)3![]() Cr3++3OH-下列有关说法中正确的是
Cr3++3OH-下列有关说法中正确的是
a.加 HCl 则平衡均向右移动,则生成 Cr3+盐
b.按照物质分类 Cr(OH)3 是两性氢氧化物,属于弱电解质
c.Cr3+盐中逐滴加入 NaOH 溶液,先产生沉淀,后沉淀消失
d.Cr(OH)3 饱和溶液中一定有 c(H )=c(OH )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5mol某气态烃能与1molHCl发生加成反应,生成氯代烷,0.5mol此氯代烷可与3mol氯气发生完全的取代反应,则该烃可能为
A. 乙烯 B. 丙烯 C. 乙炔 D. 丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2molL﹣1 NaOH的溶液450mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
A.500mL,40g
B.500mL,36g
C.450mL,36g
D.450mL,40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段成为钡餐透视。
(1)医学上进行钡餐透视时为什么不用BaCO3的理由是________ (用离子方程式表示)。
(2)某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:
A.5 mL水;
B.40 mL 0.2 molL-1的Ba(OH)2溶液;
C.20 mL 0.5 molL-1的Na2SO4溶液;
D.40 mL 0.1 molL-1的H2SO4溶液中。
①溶解BaSO4后形成的溶液中,Ba2+|的浓度由大到小的顺序为________(填字母)。
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298 K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液b中加入BaSO4后,c(SO42-)为__________ molL-1,溶液c中加入BaSO4后,c(Ba2+)为__________ molL-1。
③常温下,若将溶液b和溶液d直接混合,则混合液的pH为__________(设混合溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com