
【题目】0.5mol某气态烃能与1molHCl发生加成反应,生成氯代烷,0.5mol此氯代烷可与3mol氯气发生完全的取代反应,则该烃可能为
A. 乙烯 B. 丙烯 C. 乙炔 D. 丙炔
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | ||
V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | ||
A | 25 | 5 | 0.1 | 20 | 0.1 |
B | 25 | 5 | 0.2 | 10 | 0.2 |
C | 35 | 5 | 0.1 | 20 | 0.1 |
D | 35 | 5 | 0.2 | 10 | 0.2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlH3是具有特殊性质的化合物。下列有关该化合物的说法不正确的是
A. AlH3中Al为+3价 B. 具有强还原性
C. 暴露在空气中易变质 D. 可由铝与水蒸气在高温下反应制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,在纺织、造纸、化工合成方面都有重要的用途。
(1)工业上电解饱和食盐水制取氯气:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为___L。工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式___________
2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为___L。工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式___________
(2)实验室用常用MnO2与浓盐酸共热制氯气,试写出该反应的化学方程式_____________________,若用100mL12mol·L-1的浓盐酸与足量的MnO2反应,则生成的氯气在标准状况下的体积_____6.72L(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,再逐滴加入2mol L-1的NaOH溶液至过量,所生成的沉淀与所加NaOH的关系如图所示。
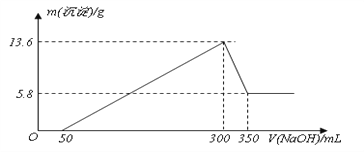
(1)0~50mL段内,发生反应的离子方程式为_________________。
(2)300~350mL段内,发生反应的离子方程式为________________。
(3)试计算该盐酸的浓度___。(写出必要的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)获取铜和胆矾的操作流程如下:

已知:①部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
②B、C均为单一沉淀
请回答下列问题:
(1)已知Cu2O在酸性条件下发生自身氧化还原反应,写出离子反应方程式______________。
(2)为了加快反应I的速率,可以采取的措施是______________(写1点)。
(3)固体混合物A中的成分是__________________________。
(4)反应I完成后,铁元素的存在形式为_______________(填离子符号);写出生成该离子的离子方程式___________________________________。
(5)x对应的数值范围是_______________________。用NaClO调pH,生成沉淀B的反应的离子方程式为____________________________________。
(6)已知:Ksp[Al(OH)3]=1.1×10-33,当调节溶液的pH为5时,c(Al3+)=_________ molL-1
(7)洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤.原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成 Hb·CO,使血红蛋白失去输送 O2 功能。CO 进入血液后有如下平衡:CO+Hb·O2![]() O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:
(2)抽烟时,进入肺部的空气中 c(CO)=10-6mol/L,c(O2 )=10-2mol/L,则 c(Hb·CO)为 c(Hb·O2)的 倍。
(3)已知当血液中c(Hb·CO)/c(Hb·O2)的比值大于 0.02 时,人的智力会很快受到损伤,为避免人的智力受到损伤,c(O2)与 c(CO)的比值应大于___________。
II 在某一温度条件下, Bodensteins 研究了反应:2HI(g) ![]() H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:
H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:

(4)根据上述实验结果,该反应的平衡常数K的计算式为_________。
(5)上述反应,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)×x(I2),其中k正、k逆为速率常数,则k逆为_________(以K和k正表示)。若k正=0.002·min-1,第一次实验时,当t=20min,v正=___________·min-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com