
【题目】I 已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成 Hb·CO,使血红蛋白失去输送 O2 功能。CO 进入血液后有如下平衡:CO+Hb·O2![]() O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:
(2)抽烟时,进入肺部的空气中 c(CO)=10-6mol/L,c(O2 )=10-2mol/L,则 c(Hb·CO)为 c(Hb·O2)的 倍。
(3)已知当血液中c(Hb·CO)/c(Hb·O2)的比值大于 0.02 时,人的智力会很快受到损伤,为避免人的智力受到损伤,c(O2)与 c(CO)的比值应大于___________。
II 在某一温度条件下, Bodensteins 研究了反应:2HI(g) ![]() H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:
H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:

(4)根据上述实验结果,该反应的平衡常数K的计算式为_________。
(5)上述反应,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)×x(I2),其中k正、k逆为速率常数,则k逆为_________(以K和k正表示)。若k正=0.002·min-1,第一次实验时,当t=20min,v正=___________·min-1。
【答案】(1)在高压氧舱中,煤气中毒患者吸入氧气浓度较高的空气后,CO+Hb·O2![]() O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能;(2)0.022;(3)>11000;(4)K=0.1082/0.7842;(5)k正/K;1.62×10-3。
O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能;(2)0.022;(3)>11000;(4)K=0.1082/0.7842;(5)k正/K;1.62×10-3。
【解析】
试题分析:(1)在高压氧舱中,煤气中毒患者吸入氧气浓度较高的空气后,CO+Hb·O2![]() O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能;(2)将c(CO)、c(CO2)代入平衡常数表达式,K=c(O2)×c(Hb·CO)/[c(CO)×c(Hb·O2)]=10-2 ×c(Hb·CO)×/[10-6×c(Hb·O2)]=220,解得c(Hb·CO)/ c(Hb·O2)=0.022;(3)根据化学平衡常数表达式:K=c(O2) × c(Hb·CO) / [c(CO) × c(Hb·O2)] = 220,c(Hb·CO)/ c(Hb·O2)=0.02,c(O2)/c(CO)=11000,即大于11000时,人的智力受损失;(4)120min时达到平衡,根据第一次实验,c(HI)=0.784mol·L-1,c(H2)=c(I2)=(1-0.784)/2mol·L-1=0.108mol·L-1,K=c(H2)×c(I2)/c2(HI)= 0.1082/0.7842;(5) 达到平衡,v正=v逆,k正x2(HI)= k逆x(H2)×x(I2),k逆=k正×x2(HI)/[x(H2)×x(I2)]= k正/K;将x(HI)=0.9,k正=0.002,代入公式,v正=1.62×10-3。
O2+Hb·CO,平衡向左移,使Hb·CO转化成Hb·O2,恢复血红蛋白的输氧功能;(2)将c(CO)、c(CO2)代入平衡常数表达式,K=c(O2)×c(Hb·CO)/[c(CO)×c(Hb·O2)]=10-2 ×c(Hb·CO)×/[10-6×c(Hb·O2)]=220,解得c(Hb·CO)/ c(Hb·O2)=0.022;(3)根据化学平衡常数表达式:K=c(O2) × c(Hb·CO) / [c(CO) × c(Hb·O2)] = 220,c(Hb·CO)/ c(Hb·O2)=0.02,c(O2)/c(CO)=11000,即大于11000时,人的智力受损失;(4)120min时达到平衡,根据第一次实验,c(HI)=0.784mol·L-1,c(H2)=c(I2)=(1-0.784)/2mol·L-1=0.108mol·L-1,K=c(H2)×c(I2)/c2(HI)= 0.1082/0.7842;(5) 达到平衡,v正=v逆,k正x2(HI)= k逆x(H2)×x(I2),k逆=k正×x2(HI)/[x(H2)×x(I2)]= k正/K;将x(HI)=0.9,k正=0.002,代入公式,v正=1.62×10-3。


科目:高中化学 来源: 题型:
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。己知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________。
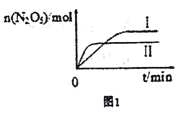
②下列有关该反应的说法正确的是________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________。
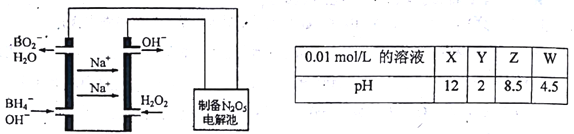
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应II达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___α1 (填“>”“<”或span>“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5mol某气态烃能与1molHCl发生加成反应,生成氯代烷,0.5mol此氯代烷可与3mol氯气发生完全的取代反应,则该烃可能为
A. 乙烯 B. 丙烯 C. 乙炔 D. 丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2molL﹣1 NaOH的溶液450mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
A.500mL,40g
B.500mL,36g
C.450mL,36g
D.450mL,40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
B. 钛及钛合金用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域
C. 明矾可以用作净水剂除去悬浮于水中的泥沙
D. 单质硅是现代光学及光纤制品的基本原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HClO、HNO3、KMnO4都是常见的氧化剂
B. SiO2、NO2、Al2O3都属于酸性氧化物
C. 雨后彩虹、血液透析、卤水点豆腐都属于化学变化
D. SO3、Na2O、甲苯都属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法正确的是( )
A. 煤经过气化和液化等物理变化可转化为清洁燃料
B. 直馏汽油和裂化汽油中均含有芳香烃
C. 用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
D. 不粘锅的原料CF2=CF2为烃类化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段成为钡餐透视。
(1)医学上进行钡餐透视时为什么不用BaCO3的理由是________ (用离子方程式表示)。
(2)某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:
A.5 mL水;
B.40 mL 0.2 molL-1的Ba(OH)2溶液;
C.20 mL 0.5 molL-1的Na2SO4溶液;
D.40 mL 0.1 molL-1的H2SO4溶液中。
①溶解BaSO4后形成的溶液中,Ba2+|的浓度由大到小的顺序为________(填字母)。
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298 K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液b中加入BaSO4后,c(SO42-)为__________ molL-1,溶液c中加入BaSO4后,c(Ba2+)为__________ molL-1。
③常温下,若将溶液b和溶液d直接混合,则混合液的pH为__________(设混合溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】优质空气利于身心健康。均会造成空气污染的一组物质是( )
A. CO2和NO2 B. SO2和NO2 C. H2O和SO2 D. H2O和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com