
【题目】工业上用矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)获取铜和胆矾的操作流程如下:

已知:①部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
②B、C均为单一沉淀
请回答下列问题:
(1)已知Cu2O在酸性条件下发生自身氧化还原反应,写出离子反应方程式______________。
(2)为了加快反应I的速率,可以采取的措施是______________(写1点)。
(3)固体混合物A中的成分是__________________________。
(4)反应I完成后,铁元素的存在形式为_______________(填离子符号);写出生成该离子的离子方程式___________________________________。
(5)x对应的数值范围是_______________________。用NaClO调pH,生成沉淀B的反应的离子方程式为____________________________________。
(6)已知:Ksp[Al(OH)3]=1.1×10-33,当调节溶液的pH为5时,c(Al3+)=_________ molL-1
(7)洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤.原因是___________________。
【答案】 Cu2O + 2H+=Cu + Cu2++H2O 适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等 SiO2、Cu Fe2+ 2Fe3++Cu = Cu2++2Fe2+ 3.2≤pH<4.0 2 Fe2+ +ClO-+ 5H2O= 2Fe(OH)3↓+ Cl-+ 4H+ 1.1×10-6 CuSO4可溶于水,冰水可以减少CuSO4晶体的损失
【解析】本题考查化学工艺流程,(1)Cu2O在酸性条件下发生歧化反应,Cu2O中Cu显+1价,歧化反应是同一种元素化合价升高,且化合价降低,即离子反应方程式为Cu2O+2H+=Cu+Cu2++H2O;(2)适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等;(3)根据反应I,Cu2O发生歧化反应生成Cu和Cu2+,Cu不与稀硫酸反应,SiO2属于酸性氧化物,不与稀硫酸反应,因此固体混合物A中含有成分是Cu和SiO2;(4)Fe2O3是碱性氧化物,与硫酸反应生成Fe3+,Fe3+具有强氧化性,与Cu发生:Cu+2Fe3+=2Fe2++Cu2+,反应I后,铁元素以Fe2+形式存在;(5)根据流程两次调节pH,第一次调节pH时,加入NaClO,利用NaClO的氧化性,把Fe2+氧化成Fe3+,然后调节pH,使Fe(OH)3沉淀出来,因此x的范围是3.2≤pH<4.0 ;离子反应方程式为:2Fe2+ +ClO-+ 5H2O= 2Fe(OH)3↓+ Cl-+ 4H+ ;(6)此时溶液的c(OH-)=Kw/c(H+)=10-14/10-5=10-9mol·L-1,根据溶度积的定义,c(Al3+)=Ksp/c3(OH-)=1.1×10-33/(10-9)3=1.1×10-6mol·L-1;(7)CuSO4可溶于水,冰水可以减少CuSO4晶体的损失。


科目:高中化学 来源: 题型:
【题目】向容积为2L的密闭容器中充入一定量的H2O和CO,维持700℃发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
反应时间/min | n(CO)/mol | H2O/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 其他条件不变,起始时容器中充入0.60molCO和1.20 molH2O,达平衡时,n(CO2)=0.40 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D. 若温度升至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌、鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
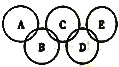
(1)火焰利用了部分金属元素特征的________反应,该反应属于_________(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含的电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为![]() ,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
①B的水溶液呈弱酸性,其主要的电离方程式可表示为________________,D的化学式是_____________。
②A、B、E中均含有的一种元素为____________(填元素名称)。
③E的电子式为______________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸发生反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5mol某气态烃能与1molHCl发生加成反应,生成氯代烷,0.5mol此氯代烷可与3mol氯气发生完全的取代反应,则该烃可能为
A. 乙烯 B. 丙烯 C. 乙炔 D. 丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2molL﹣1 NaOH的溶液450mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
A.500mL,40g
B.500mL,36g
C.450mL,36g
D.450mL,40g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
B. 钛及钛合金用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域
C. 明矾可以用作净水剂除去悬浮于水中的泥沙
D. 单质硅是现代光学及光纤制品的基本原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法正确的是( )
A. 煤经过气化和液化等物理变化可转化为清洁燃料
B. 直馏汽油和裂化汽油中均含有芳香烃
C. 用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
D. 不粘锅的原料CF2=CF2为烃类化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中通常伴随着能量的变化,下列说法中错误的是( )。
A.煤燃烧时将部分化学能转化为热能
B.光合作用时将光能转化为电能
C.火药爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com