
����Ŀ��ҹĻ���٣��������˻����᳡�������ڵƻ�Ի͡���ɪ�������貵��̻��ڿ�����ɰ����廷��ͼ�����볡�ڱ������Ӧ����ҹ�����������������ɣ��������������Դ�ͳ�Ļ�Ԫ�����й�����Ϊ��ɫ����ش��������⣺
��1�����������˲��ֽ���Ԫ��������________��Ӧ���÷�Ӧ����_________(����������������ѧ��)�仯��
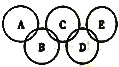
��2����ͼ��ʾ����Ԫ������A��B��C��D��E���ֻ����ԲȦ���沿��ָ���ֻ����ﺬ��һ����ͬԪ�أ����ֻ����������ֶ�����Ԫ���γɣ�ÿ�ֻ������������Ԫ�أ�A����������Ҫ�ɷ֣�B��E�����������ĵ�������Ϊ18��B���ȶ������н�ǿ�������ԣ���ϡ��Һ��ҽ���Ϲ㷺ʹ�õ���������E�ķ��ӽṹģ��Ϊ![]() ��C�������ά����Ҫ���ϣ�D����������Ԫ�ص�ԭ�Ӹ�����Ϊ3��4����Ԫ�ص�ԭ������֮��Ϊ2��1��
��C�������ά����Ҫ���ϣ�D����������Ԫ�ص�ԭ�Ӹ�����Ϊ3��4����Ԫ�ص�ԭ������֮��Ϊ2��1��
��B��ˮ��Һ�������ԣ�����Ҫ�ĵ��뷽��ʽ�ɱ�ʾΪ________________��D�Ļ�ѧʽ��_____________��
��A��B��E�о����е�һ��Ԫ��Ϊ____________(��Ԫ������)��
��E�ĵ���ʽΪ______________��
��NH3�����е�Nԭ����һ�Թ¶Ե��ӣ��ܷ�����Ӧ��NH3+HCl=NH4Cl����д��E���������ᷢ����Ӧ�Ļ�ѧ����ʽ��__________________________��
���𰸡���1����ɫ������
��2����H2O2![]() HO2-+H+��Si3N4
HO2-+H+��Si3N4
������
��N2H4+2HCl=N2H6Cl2
�������������������1���̻��������뵽���ֽ�����Ԫ�ص���ɫ��Ӧ�����������ӵļ����������ģ��������仯�ġ���2��A����������Ҫ�ɷ�֪���Ǽ��飬B���ȶ������н�ǿ�������ԣ���ϡ��Һ��ҽ���Ϲ㷺ʹ�õ�����������֪��B��H2O2��������ȷ��B��C�ཻ�IJ���ΪO��E�ķ��ӽṹģ��֪��ΪN2H4��C�������ά����Ҫ���ϣ�CΪ�������裬D����������Ԫ�ص�ԭ�Ӹ�����Ϊ3��4����Ԫ�ص�ԭ������֮��Ϊ2��1��DΪ�����衣��H2O2��ˮ��Һ�������ԣ�����뷽��ʽ�ɱ�ʾΪH2O2![]() HO2-+H+�����ݻ��ϼ�D�Ļ�ѧʽ��Si3N4����A��B��E�о����е�һ��Ԫ��Ϊ�⣻��N2H4�ĵ���ʽΪ
HO2-+H+�����ݻ��ϼ�D�Ļ�ѧʽ��Si3N4����A��B��E�о����е�һ��Ԫ��Ϊ�⣻��N2H4�ĵ���ʽΪ ����N2H4���������ᷢ����Ӧ�Ļ�ѧ����ʽ��N2H4+2HCl=N2H6Cl2��
����N2H4���������ᷢ����Ӧ�Ļ�ѧ����ʽ��N2H4+2HCl=N2H6Cl2��


 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC4H8O���л�������������������ͭ���ȷ�Ӧ����ש��ɫ������ͬ���칹����
A. 2�� B. 3�� C. 4�� D. 5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������Ksp[Mg(OH)2]=1.8��10-11�� Ksp[Fe(OH)3]=4.0��10-38��
��1�����³�ѹ����������ȼ����Ϊ285.8 kJ��mol-1��������ȼ�յ��Ȼ�ѧ����ʽΪ__________
��2�������ӷ���ʽ��ʾ�ظ��������Һ�д��ڵ�ƽ�⣺__________
��3����Ũ�Ⱦ�Ϊ0.1 mol/L����������Һ��С�մ���Һ��ϣ���Ӧ�����ӷ���ʽΪ__________
��4����Ũ�Ⱦ�Ϊ0.1 mol/L�������������Һ��ϡ�����ϣ���Ӧ�����ӷ���ʽΪ__________
��5����Mg(OH) 2����Һ�еμ�2��0.1 mol/L FeCl3��Һ����Ӧ�����ӷ���ʽΪ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��AlH3�Ǿ����������ʵĻ���������йظû������˵������ȷ����
A. AlH3��AlΪ+3�� B. ����ǿ��ԭ��
C. ��¶�ڿ������ױ��� D. ��������ˮ�����ڸ����·�Ӧ�Ʊ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���õ������������������Ʒ�����γ����ܡ���ʴ������Ĥ���������Һһ��ΪH2SO4-H2C2O4�����Һ������������������
A. ���ӹ�����ƷΪ����
B. ��ѡ�ò��������Ϊ����
C. �����ĵ缫��ӦʽΪ��Al3++3e-=Al
D. ����������ڵ��������������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ�����ⶨ��ˮ��Ũ�ȣ�������ѡ���ָʾ����
A. ���� B. ��̪ C. ʯ�� D. �����Լ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ĺ�ҵԭ�ϣ��ڷ�֯����ֽ�������ϳɷ��涼����Ҫ����;��
��1����ҵ�ϵ�ⱥ��ʳ��ˮ��ȡ������2NaCl+2H2O![]() 2NaOH+H2��+Cl2����������ÿת��1mol���ӣ����ɵ������ڱ�״���µ����Ϊ___L����ҵ�Ͻ����ɵ�����ͨ��ʯ������ȡƯ�ۣ���д���÷�Ӧ�Ļ�ѧ����ʽ___________
2NaOH+H2��+Cl2����������ÿת��1mol���ӣ����ɵ������ڱ�״���µ����Ϊ___L����ҵ�Ͻ����ɵ�����ͨ��ʯ������ȡƯ�ۣ���д���÷�Ӧ�Ļ�ѧ����ʽ___________
��2��ʵ�����ó���MnO2��Ũ���Ṳ������������д���÷�Ӧ�Ļ�ѧ����ʽ_____________________������100mL12mol��L-1��Ũ������������MnO2��Ӧ�������ɵ������ڱ�״���µ����_____6.72L���>������<����=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ÿ���������Cu2O��Al2O3��Fe2O3��SiO2����ȡͭ�͵����IJ����������£�

��֪���ٲ���������������������ʽ����ʱ��Һ��pH���±���
������ | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
��ʼ����pH | 5.4 | 4.0 | 1.1 | 5.8 |
������ȫpH | 6.7 | 5.2 | 3.2 | 8.8 |
��B��C��Ϊ��һ����
��ش��������⣺
��1����֪Cu2O�����������·�������������ԭ��Ӧ��д�����ӷ�Ӧ����ʽ______________��
��2��Ϊ�˼ӿ췴ӦI�����ʣ����Բ�ȡ�Ĵ�ʩ��______________��д1�㣩��
��3����������A�еijɷ���__________________________��
��4����ӦI��ɺ���Ԫ�صĴ�����ʽΪ_______________�������ӷ��ţ���д�����ɸ����ӵ����ӷ���ʽ___________________________________��
��5��x��Ӧ����ֵ��Χ��_______________________����NaClO��pH�����ɳ���B�ķ�Ӧ�����ӷ���ʽΪ____________________________________��
��6����֪��Ksp[Al(OH)3]=1.1��10-33����������Һ��pHΪ5ʱ��c(Al3+)=_________ molL-1
��7��ϴ��CuSO4��5H2O�ֲ�Ʒ�����ô���ˮϴ�����ñ�ˮϴ�ӣ�ԭ����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ���ļ�����Һ�У��ܴ���������������ǣ�������
A. Na+��H+��SO42����HCO3��
B. Cu2+��K+��SO42����NO3��
C. Na+��K+��Cl����NO3��
D. Mg2+��K+��SO42����Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com