
【题目】某无色透明的碱性溶液中,能大量共存的离子组是( )
A. Na+、H+、SO42﹣、HCO3﹣
B. Cu2+、K+、SO42﹣、NO3﹣
C. Na+、K+、Cl﹣、NO3﹣
D. Mg2+、K+、SO42﹣、Cl﹣
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
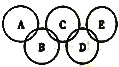
【题目】夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌、鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。请回答下列问题:
(1)火焰利用了部分金属元素特征的________反应,该反应属于_________(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含的电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为![]() ,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
,C可作光导纤维的主要材料,D中所含两种元素的原子个数比为3∶4,两元素的原子序数之比为2∶1。
①B的水溶液呈弱酸性,其主要的电离方程式可表示为________________,D的化学式是_____________。
②A、B、E中均含有的一种元素为____________(填元素名称)。
③E的电子式为______________。
④NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸发生反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物
B. 钛及钛合金用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域
C. 明矾可以用作净水剂除去悬浮于水中的泥沙
D. 单质硅是现代光学及光纤制品的基本原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法正确的是( )
A. 煤经过气化和液化等物理变化可转化为清洁燃料
B. 直馏汽油和裂化汽油中均含有芳香烃
C. 用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
D. 不粘锅的原料CF2=CF2为烃类化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:H2(g) + I2 (g) ![]() 2HI(g) ΔH<0,现有三个相同的体积均为 1 L 的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入 1 mol H2 和 1 molI2 (g),在Ⅱ中充入 2 molHI(g),在Ⅲ中充入 2 mol H2 和2 mol I2 (g),700℃条件下开始反应。达到平衡时,下列说法正确的是( )
2HI(g) ΔH<0,现有三个相同的体积均为 1 L 的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入 1 mol H2 和 1 molI2 (g),在Ⅱ中充入 2 molHI(g),在Ⅲ中充入 2 mol H2 和2 mol I2 (g),700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C.容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D.容器Ⅰ中 H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段成为钡餐透视。
(1)医学上进行钡餐透视时为什么不用BaCO3的理由是________ (用离子方程式表示)。
(2)某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:
A.5 mL水;
B.40 mL 0.2 molL-1的Ba(OH)2溶液;
C.20 mL 0.5 molL-1的Na2SO4溶液;
D.40 mL 0.1 molL-1的H2SO4溶液中。
①溶解BaSO4后形成的溶液中,Ba2+|的浓度由大到小的顺序为________(填字母)。
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
②已知298 K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液b中加入BaSO4后,c(SO42-)为__________ molL-1,溶液c中加入BaSO4后,c(Ba2+)为__________ molL-1。
③常温下,若将溶液b和溶液d直接混合,则混合液的pH为__________(设混合溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1 mol H—H键吸收a kJ能量,则2 mol氢原子所具有的能量比1 mol H2具有的能量( )。
A.高a kJ B.低a kJ
C.高2a kJ D.低2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中通常伴随着能量的变化,下列说法中错误的是( )。
A.煤燃烧时将部分化学能转化为热能
B.光合作用时将光能转化为电能
C.火药爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).

实验操作 | 实验现象 |
i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化,继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是 .
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2.
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是 .
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是 .
③iii中滴入少量H2O2没有明显变化.提出假设:
观点1:H2O2的量少不能氧化Br-
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是 .
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com