
����Ŀ�����ĵ��ʼ�һЩ�������ڹ�ũҵ��������������Ҫ���ã��ش���������
(1)Nԭ�Ӻ�����________��ͬ�˶�״̬�ĵ��ӡ���̬Nԭ���У�������ߵĵ�����ռ�ݵ�ԭ�ӹ����״Ϊ_____________________��
(2)N��ͬһ�������������ڵ�����Ԫ��ԭ�ӵĵ�һ�����ܴ�С��ϵΪ______________(��Ԫ������)���õ����ܴ�С�仯��ԭ��Ϊ______________________________________________��
(3)���ⶨ���֣�N2O5������NO2+��NO3������������ɣ��ù�����Nԭ���ӻ�����Ϊ____________________����NO2+��Ϊ�ȵ����������_______________(д��һ��)��
(4)������ijЩ�������Co3+��λ�����ж�CoԪ��λ��Ԫ�����ڱ��е�____________��(��s��p��d��ds��f)����д����CoԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽ________________________��Co3+��һ��������[Co(N3)(NH3)5]2+�У�Co3+����λ��Ϊ_______________����֪����N3����CO2Ϊ�ȵ����壬�ж�N3���Ŀռ����幹��Ϊ_____________________��
(5)��֪N�ĵ縺�Դ���Cl��NCl3����ˮ�������ҵ�ˮ�ⷴӦ����Ӧ�õ����ָ��г����Ļ�ѧ���ʣ������Ļ�ѧ����ʽΪ_______________________________________________��
(6)��H��C��N��O����Ԫ�ع�ͬ��ɵ���ԭ�ӷ��Ӿ��ж��ֲ�ͬ�Ľṹ����д���������������ȶ��ṹ����״�칹��ĵ���ʽ____________________��______________________��
���𰸡� 7 ����״(��Ĵ���) ��������̼ ͬ����Ԫ�ش����Һ˵�������Ե��ӵ���������ǿ����һ���������������Nԭ�Ӻ�����Ӿ��а������ͣ��Ƚ��ȶ�����һ�����ܷ������ sp��sp3 CO2��N3����CS2��SiO2��SCN���� d [Ar]3d74s2��1s22s22p63s23p63d74s2 6 ֱ���� NCl3 + H2O = NH3��+ HClO (���š�����Ҫ��) �� ��
�����������������������ʽṹ���ۺ����ͣ��漰�ܶ�֪ʶ�㣬��ȷ�������������գ���1�������ж��ٵ��ӣ����ж������˶�״̬���������ڵ��ܲ�Խ�ߣ�����Խ��2�������ڱ��У�ͬ���ڴ������ҵ�����������s2��p3�������ȫ���Ͱ���״̬����һ�����ܱȺ�һ��Ԫ�ش�������N��O����3���ȵ������ǣ�ԭ�Ӹ�����ͬ���۵�������ͬ���ռ乹����ͬ��������ԭ�ӵ��ӻ�����Ҳ��ͬ������NO2+��CO2�ǵȵ����壬��sp�ӻ���NO3����sp2�ӻ�����4��Co�ĺ˵������27�����������Ų�ʽ��1s22s22p63s23p63d74s2������d��Ԫ�أ�������[Co(N3)(NH3)5]2+�У� N3-��NH3�����壬����Co3+����λ��Ϊ6����5��NCl3��NԪ�ػ��ϼ�Ϊ-3����ClԪ�ػ��ϼ�Ϊ+1������Ӧ�� �� ѧ �� �� ʽ ΪNCl3 + H2O = NH3��+ HClO����6��C��H��O��N�����γɵĺ�4��ԭ�ӵĻ���������HCNO��HOCN�������ʽ��![]() ��
��![]() ��
��
��⣺��1����Ԫ����7��Ԫ�أ����������7���������Ų�ʽΪ��1s22s22P3 �������������ܼ�����ԭ�Ӻ����3�ֲ�ͬ�ܼ��ĵ��ӣ���ԭ�Ӻ���������е���չ������s�����ε�ֻ��һ�֣�P�����3�֣�����3��չ��������ͬһ����ϵ�����������������ͬ���ʹ���7�ֲ�ͬ�˶�״̬�ĵ��ӡ�������ߵĵ�����ռ�ݵ�ԭ�ӹ����2p�����p�������״Ϊ����״(��Ĵ���)��������ȷ�𰸣�7������״(��Ĵ���)��
��2��N��ͬһ�������������ڵ�����Ԫ��ԭ�ӷֱ���C��O��N��O��C����Ԫ����ͬ����Ԫ�أ���ԭ�����������࣬ԭ�Ӻ˶Ե��ӵ���������ǿ����һ������������N��O��C����Ԫ��������Nԭ�ӵ�2p����ǰ����״̬���Ƚ��ȶ�����һ�����ܷ�������ͬ���ڵ���Ԫ��Ҫ������3��Ԫ�صĵ�һ�������ɴ�С˳��Ϊ����>��>̼����ȷ�𰸣���>��>̼��ͬ����Ԫ�ش����Һ˵�������Ե��ӵ���������ǿ����һ���������������Nԭ�Ӻ�����Ӿ��а������ͣ��Ƚ��ȶ�����һ�����ܷ��������
��3��NO2+(����������)�۵��Ӷ���2������CO2�ǵȵ����壬���ι����dz�ֱ���ͣ��������е����ӻ��������Ϊsp�ӻ���NO3-(���������)�۵��Ӷ�����3���������ӹ���Ϊƽ���������Σ����� �����ӻ��������Ϊsp2�ӻ����ȵ������ǣ�ԭ�Ӹ�����ͬ���۵�������ͬ��NO2+ԭ�Ӹ�����3���۵���������16��������ȵ���������У�CO2��N3����CS2��SCN��������ȷ����sp��sp2��CO2��N3����CS2��SCN������
��4��Co�ĺ˵������27��CoԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽ��1s22s22p63s23p63d74s2��λ�����ڱ��е����������ڢ��壬����d��Ԫ�أ�Co3+��һ��������[Co(N3)(NH3)5]2+�У��������������ۣ�N3-��NH3�����壬����Co3+����λ��Ϊ6������N3����CO2Ϊ�ȵ��������ȵ�����Ľṹ����ͬ�ģ�CO2�Ŀռ乹����ֱ���Σ�����N3���Ŀռ����幹��Ϊ��ֱ���Σ���ȷ�𰸣�d�� [Ar]3d74s2��1s22s22p63s23p63d74s2�� 6��ֱ���� ��
��5���� ֪N�� �� �� �� �� �� Cl �� NCl3��NԪ�ػ��ϼ�Ϊ-3����ClԪ�ػ��ϼ�Ϊ+1����NCl3���� ˮ���� �� �ҵ�ˮ�� �� Ӧ����Ӧ�õ�NH3��HClO����Ӧ�� �� ѧ �� �� ʽ ΪCl3 + H2O = NH3��+ HClO����ȷ�𰸣�NCl3 + H2O = NH3��+ HClO��
��6������C��N��O��H�ļۼ����ۣ�C��H��O��N�����γɵĺ�4��ԭ�ӵĻ���������HCNO��HOCN�������ʽ��![]() ��
��![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��![]() ��
��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(ʵ����)Ϊ��֤±�ص��������Ե����ǿ��,ijС������ͼ��ʾװ�ý���ʵ��(�г���������ȥ,�������Ѽ���)
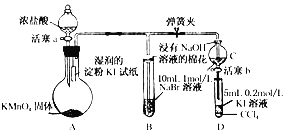
ʵ�����:
��.���ɼ�,����a,�μ�Ũ����
��.��B��C�е���Һ����Ϊ��ɫʱ,�н����ɼ�
��.��B����Һ�ɻ�ɫ��Ϊ�غ�ɫʱ,�رջ���a
��.����
(1)A�в�������ɫ����,�����ʽ��____________________
(2)��֤������������ǿ�ڵ��ʵ��������____________________
(3)B����Һ������Ӧ�����ӷ���ʽ��____________________
(4)Ϊ��֤���������ǿ�ڵ�,���̢��IJ�����������__________________________________________
(5)���̢�ʵ���Ŀ����____________________
(6)����ⵥ�ʵ�������������ԭ��:ͬ����Ԫ�ش��ϵ���_________,�õ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ�в��ܷ����������
A. ͭ B. ̼���ƹ���
C. �Ȼ������� D. �������ع���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ100mL�����п��ܺ�Fe3����Al3����Na����Mg2����Cu2����NH4+��K����CO32-��SO42-�������еļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й���������ͼ��ʾ��

��ش��������⣺
(1)��ɫ��Ӧ��_____(����������������ѧ��)�仯��ʵ����в�������ɫ��ζ������_____(�ѧʽ)��
(2)ԭ��Һ��һ�����ڵ�������______________�����ܴ��ڵ�������_____________________��һ�������ڵ�������______________(д��ѧʽ)��
(3)����Һ��K�����ʵ���Ϊ0.04 mol����c(Na��)=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ�Ӻ�������Ų�Ϊns2np7����Υ����
A. �������ԭ��B. ����������ԭ��C. ���ع���D. ���ع�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬����ͽ��۾���ȷ����
ѡ�� | �� | �� | �������� | ���� | װ��ͼ |
A | Ũ���� | Cu | ����-KI��Һ���� | NO2Ϊ���������� |
|
B | ϡ���� | Na2SO3 | Ʒ����Һ��ɫ | Na2SO3δ���� | |
C | Ũ���� | MnO2 | FeBr2��Һ��Ϊ��ɫ | �����ԣ�Cl2��Br2 | |
D | Ũ��ˮ | NaOH | ʪ���ɫʯ����ֽ���� | NH3Ϊ�������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������X��������Na2SiO3��Fe��Na2CO3�� BaCl2�е����ֻ��������ϵ�������ɡ�ij��ȤС��Ϊ̽���ù����������ɣ����ʵ�鷽������ͼ��ʾ�������Լ�����������

����˵������ȷ���ǣ�
A. ����Aһ���ǻ������
B. ����Aһ����H2SiO3
C. ��ɫ����B�ڿ����������ɫ��������ɫ
D. �ù�������һ������Fe��Na2CO3��BaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA ���������ӵ�������ֵ������˵����ȷ���ǣ� ��
A. 1mol O2 ��Ϊ���������뷴Ӧ���õ��ĵ�����һ��Ϊ 4NA
B. 1mol Fe ������ϡ���ᷴӦ��ʧȥ�ĵ������� 3NA
C. 0.4mol��L��1Na2SO4 ��Һ�У����� Na����SO42- ����Ϊ 1.2NA
D. ��״���£�23g Na ��ռ�����һ��С�� 22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й������仯�����������ȷ����(����)
A. �������������ڸ����¿��Է������ȷ�Ӧ
B. ���������ֱ������������������������Һ��Ӧ�����������������ͬ
C. ��ҵ���õ������AlCl3�ķ���ұ����
D. ����������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com