
【题目】现有含少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,用适当的试剂除去杂质,得到纯净的NaNO3固体的实验流程如图所示。

(1)沉淀A的主要成分是_________(填化学式)。
(2)②中反应的化学方程式是_________。
(3)①②③中均进行的分离操作是_________。
(4)实验室用上述实验获得的NaNO3固体配制480 mL 0.40 mol.L-1NaNO3溶液。
①配制溶液前要先计算,需称取NaNO3固体_______g。
②某同学转移溶液的操作如图所示,图中仪器的名称是烧杯和______,该同学操作中的错误是______。
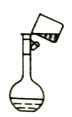
③若用胶头滴管定容时,不小心加水超过了刻度线,则应该采取的处理方法是_____。
④下列操作中,可能造成所配制溶液的浓度偏低的是_____(填字母)。
a.没有洗涤烧杯和玻璃棒
b.定容时,俯视刻度线
c.洗涤后的容量瓶中残留少量蒸馏水
【答案】 BaSO4、BaCO3 AgNO3+NaCl=AgCl↓+NaNO3 过滤 17.0 500mL容量瓶 未用玻璃棒引流 重新配制溶液 a
【解析】(1)硫酸钠、碳酸钠与硝酸钡均反应生成沉淀,则沉淀A的主要成分是BaSO4、BaCO3。(2)溶液1中含有氯化钠、过量的硝酸钡,加入硝酸银溶液产生氯化银沉淀,则②中反应的化学方程式是AgNO3+NaCl=AgCl↓+NaNO3。(3)①②③中均进行的分离操作是固液分离,属于过滤操作。(4)①需要使用500mL容量瓶,则需称取NaNO3固体的质量是0.5L×0.4mol/L×85g/mol=17.0g。②图中仪器的名称是烧杯和500mL容量瓶,该同学操作中的错误是未用玻璃棒引流。③若用胶头滴管定容时,不小心加水超过了刻度线,实验失败,则应该采取的处理方法是重新配制溶液。④a.没有洗涤烧杯和玻璃棒,溶质减少,浓度偏低;b.定容时,俯视刻度线,溶液体积减少,浓度偏高;c.洗涤后的容量瓶中残留少量蒸馏水不影响,答案选a。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是 ( )
A. 盐酸与Fe(OH)3反应:Fe(OH)3+3H+==Fe3++3H2O
B. 稀硫酸与铁粉反应:2Fe+6H+==2Fe3++3H2↑
C. 氢氧化钡溶液与稀硫酸反应:Ba2++SO![]() ==BaSO4↓
==BaSO4↓
D. Fe3O4与盐酸反应:Fe3O4+8H+==3Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:

请回答以下问题:
(1)操作a的名称是_______,所用玻璃仪器有____________________________________。
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为_____________溶液(写化学式);在III步中,判断试剂乙已加入过量的方法是:_______________。
(3)固体H所含物质的化学式为_________________________________________。
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,此过程中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下图九种物质均是由短周期元素组成的常见物质,X、Y、Z为单质,A、E、F、G为二元化合物,A的焰色反应为黄色,B常温常压下为无色易挥发的液体。E为合成食品保鲜膜的单体,回答下列问题:

(1)A是________(填化学式),为_______化合物(填“离子”或“共价”)。
(2)E的电子式为_______,G的水溶液为________(填“强酸”或“弱酸”)。
(3)写出B与浓D反应的化学方程式________,该反应类型为________。
(4)F的核磁共振氢谱有______个峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/( mol·L1) | 0.1 | 0.2 | 0 |
平衡浓度/( mol·L1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.反应达到平衡时,X和Y的转化率相等
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.若该反应的正反应方向为放热反应,升高温度,化学反应速率增大,反应的平衡常数也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液中的下列关系式不正确的是( )
A. 已知A-+H2B(过量)![]() HA+HB-,则结合H+的能力:HB-<A-<B2-
HA+HB-,则结合H+的能力:HB-<A-<B2-
B. 在0.1 molL-1的氨水中滴加0.1 molL-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-a molL-1
C. 将c molL-1的醋酸溶液与0.02 molL-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=![]()
D. 将0.2 mol·L-1盐酸与0.1 mol·L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序:c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 不能发生丁达尔效应的分散系有氯化钠溶液、水等
B. 将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
C. 黄河入海口处三角洲的形成与胶体性质有关
D. 电泳现象说明胶体带电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系

C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com