
| A. | z=2 | B. | 2s后,容器内的压强是初始的$\frac{7}{8}$倍 | ||
| C. | 2s时C的体积分数为$\frac{2}{7}$ | D. | 2s后,B的浓度为0.5mol/L |
分析 2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)?2C(g)+zD(g),2s后A的转化率为50%,则参加反应的n(A)=2mol×50%=1mol,v(A)=$\frac{\frac{1mol}{2L}}{2s}$=0.25mol•L-1•s-1,
A.同一化学反应中,反应速率之比等于其计量数之比,A、D的反应速率相等,所以z=2;
B.2s后,剩余n(A)=2mol×(1-50%)=1mol,剩余n(B)=2mol-$\frac{1mol}{2}×3$=0.5mol,生成n(C)=n(D)=1mol,其压强之比等于物质的量之比;
C.相同条件下,气体摩尔体积体积相等,所以C的体积分数等于其物质的量分数;
D.2s后n(B)=0.5mol,则c(B)=$\frac{n(B)}{V}$.
解答 解:2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)?2C(g)+zD(g),2s后A的转化率为50%,则参加反应的n(A)=2mol×50%=1mol,v(A)=$\frac{\frac{1mol}{2L}}{2s}$=0.25mol•L-1•s-1,
A.同一化学反应中,反应速率之比等于其计量数之比,A、D的反应速率相等,所以z=2,故A正确;
B.2s后,剩余n(A)=2mol×(1-50%)=1mol,剩余n(B)=2mol-$\frac{1mol}{2}×3$=0.5mol,生成n(C)=n(D)=1mol,其压强之比等于物质的量之比,所以反应前后压强之比=(2+2)mol:(1+0.5+1+1)mol=8:7,所以2s后,容器内的压强是初始的$\frac{7}{8}$倍,故B正确;
C.相同条件下,气体摩尔体积体积相等,所以C的体积分数等于其物质的量分数=$\frac{1mol}{(1+0.5+1+1)mol}$=$\frac{2}{7}$,故C正确;
D.2s后n(B)=0.5mol,则c(B)=$\frac{n(B)}{V}$=$\frac{0.5mol}{2L}$=0.25mol/L,故D错误;
故选D.
点评 本题考查化学平衡有关计算,为高频考点,涉及反应速率与计量数关系的计算、物质浓度计算、体积分数计算等知识点,侧重考查学生分析计算能力,题目难度不大.


科目:高中化学 来源:2017届湖北省高三联合考试化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增加。m、n、p是由这些元素组成的二元化合物,W2、X2、Z2分别是元素W、X、Z的单质。已知:
I.一定条件下某密闭容器中可发生反应:aX2+bW2 cm,反应过程中物质的浓度变化如下:
cm,反应过程中物质的浓度变化如下:
| X2 | W2 | m |
起始浓度/mol·L-1 | 0.4 | 0.4 | 0 |
平衡浓度/mol·L-1 | 0.3 | 0.1 | 0.2 |
II.它们可发生如下反应:2m(g)+3Z(g)=6n(g)+X2(g);4n(g)+Y2(g) 2p(l)+2Z2(g)。
2p(l)+2Z2(g)。
下列说法正确的是
A.原子半径:W<X<Y B.a:b:c=3:1:2
C.X的氧化物一定是无色气体 D.m、n、p三种物质均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol•L-1 | B. | 0.8mol•L-1 | C. | 1.0mol•L-1 | D. | 1.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
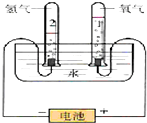 水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图.
水是人类宝贵的自然资源,也是一种重要的化工原料.如图是电解水原理的实验装置图. .
.| 质 量 | 物质的量 | O2与H2的体积比(同温同压下) | |
| O2 | 3.2g | 0.1mol | 1:2 |
| H2 | 0.4g | 0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 VO2++2H++V2+..下列说法正确的是( )
VO2++2H++V2+..下列说法正确的是( )| A. | 放电时正极反应为:VO${\;}_{2}^{+}$+2H++e-═VO2++H2O | |
| B. | 充电过程中,H+由阴极区向阳极区迁移 | |
| C. | 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极 | |
| D. | 充电时阴极反应为:V2+-e-═V3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干水是纯净物 | B. | 干水和干冰是同一种物质 | ||
| C. | 干水中的水分子不再运动 | D. | 用干水能更好地吸收CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com