
【题目】2SO2(g)+O2(g)=2SO3(g) ΔH=-198kJ/mol,在V2O5存在时,该反应的机理为:V2O5+SO2![]() 2VO2+SO3(快) 4VO2+O2
2VO2+SO3(快) 4VO2+O2![]() 2V2O5(慢)
2V2O5(慢)
下列说法正确的是
A. 反应速率主要取决于V2O5的质量 B. VO2是该反应的催化剂
C. 逆反应的活化能大于198kJ/mol D. 增大SO2的浓度可显著提高反应速率
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】资料显示,可用次氯酸钠处理废水中的氨氮(NH3),使其转化为氮气除去,其主要反应如下:
① NH3(aq)+ HClO(aq)═ NH2Cl(aq)+ H2O(l)
② 2NH2Cl(aq)+ HClO(aq)═ N2(g)+ H2O(l)+ 3HCl(aq)
(1)在其他条件不变的情况下,向一定量废水中逐滴滴加次氯酸钠溶液,氨氮去除率随n(NaClO)/n(NH3)的变化曲线如下:
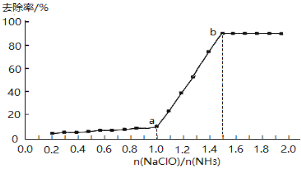
Ⅰ.物质NH2Cl中氮元素的化合价是____________。
Ⅱ.a-b点间,溶液中氨氮去除率迅速提高的原因是__________。
(2)Ⅰ.反应①②中HClO 的来源用化学用语解释是__________。
Ⅱ.实验测得,废水中pH与氨氮去除率如图所示:
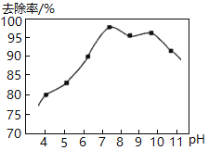
pH较高时,氨氮去除率下降的原因是__________。
pH较低时,氨氮去除率也下降,可能的原因是__________。
(3)运用上述原理去除废水中的氨氮,可结合下图所示的电解法。
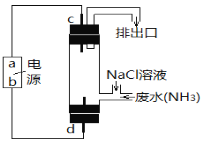
Ⅰ. a极为__________。
Ⅱ. d极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置可进行二氧化硫的制备和某些性质的实验,请回答下列问题:

(1)A中盛放浓硫的仪器名称是______________。
(2)实验过程中,装置B试管内的___________现象证明SO2具有______性。
(3)实验过程中,装置C试管内的__________现象证明SO2具有______性,反应化学方程式为_____________。
(4)D的作用是_______。
(5)尾气可采用_____________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙分别是甲烷、苯中的一种,已知:乙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色;甲既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应,且一定条件下,1 mol甲可以和3 mol H2完全加成。
(1)甲的结构简式:___________,乙的空间结构:______________________;
(2)写出乙与Cl2反应生成一氯代物的化学方程式:__________________________________________;
(3)把甲加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在_________(填“上”或“下”)层;
(4)在浓硫酸作用下,甲与浓硝酸反应的化学方程式:_________________________________________;
(5)等物质的量的甲、乙完全燃烧消耗O2的物质的量________________(填“甲>乙”、“甲<乙”或“甲=乙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有下图所示物质相互转换关系

试回答:
(1)写出B的化学式__________,D的化学式__________;
(2)写出由E转变成F的化学方程式__________;
(3)向G溶液中加入A的离子方程式__________;
向G溶液中加入铜片的离子方程式__________;
(4)简述B溶液中阳离子的检验方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电极上每通过96500 C的电量就会有1 mol电子发生转移。精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中,常用银电量计,如图所示。下列说法不正确的是
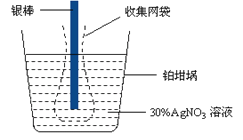
A. 若要测定电解饱和食盐水时通过的电量,可将该银电量计中的银棒与待测电解池的阳极相连,铂坩埚与电源的负极相连。
B. 称量电解前后铂坩埚的质量变化,得金属银的沉积量为108.0 mg,则电解过程中通过电解池的电量为96.5 C
C. 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会偏高。
D. 电量计中的银棒应与电源的正极相连,铂坩埚上生的电极反应是:Ag+ + e- = Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将质量m g的有机物在氧气中完全燃烧,燃烧后全部产物缓慢通过足量过氧化钠,充分反
应后过氧化钠固体增重n g,关于下列情况说法正确的是
有机物 | n | |
A | CH4 | 2m |
B | HCHO | 3m/2 |
C | CH3OH和CH3COOH的混合物 | 2m/3 |
D | C2H5OH和CH3COOC2H5的混合物 | m |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。
回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2的元素共有___种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______。
(2)已知:2UO2+5NH4HF2![]() 2UF4·NH4F+3NH3↑+4H2O↑
2UF4·NH4F+3NH3↑+4H2O↑
HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______种。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
②物质 中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
③分解所得的气态化合物的分子键角由小到大的顺序为__ (填化学式)
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C原子的配位数为______。该晶体硬度超过金刚石的原因是_________。
②已知该晶胞的密度为dg/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为_______(用含d、r1、r2、NA的代数式表示,不必化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com