
����Ŀ��Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ�����������Ч���ƿ����е������̼����������������Ե���Ϊ��Ҫ��
��1���������������ڰ�װ��ת�������ɽ�����β������Ҫ��Ⱦ��ת��Ϊ���Ĵ���ѭ�����ʡ�
��֪���� N2(g) + O2(g) ![]() 2NO(g) ��H1��+180.5 kJ��mol-1
2NO(g) ��H1��+180.5 kJ��mol-1
�� C��CO��ȼ���ȣ���H���ֱ�Ϊ-393.5 kJ��mol-1��-283 kJ��mol-1
��2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)����H �� kJ��mol-1
N2(g) + 2CO2(g)����H �� kJ��mol-1
��2����0.20 mol NO��0.10 mol CO����һ���ݻ�Ϊ1L���ܱ������У���Ӧ����������Ũ�ȱ仯��ͼ��ʾ��

��CO��0-9min�ڵ�ƽ����Ӧ����v(CO)=_______________ mol��L��1��min��1 (������λ��Ч���֣�����12 minʱ�ı�ķ�Ӧ��������Ϊ________��
A�������¶� B������NO C���Ӵ��� D�������¶�
���÷�Ӧ�ڵ�24 minʱ�ﵽƽ��״̬��CO2���������Ϊ__________��������λ��Ч���֣�����ѧƽ�ⳣ��K=___________��������λ��Ч���֣���
��3�������е�SO2����ijŨ��NaOH��Һ���յõ�Na2SO3��NaHSO3�����Һ����������Һ�����ԣ�����Һ��c(Na��)= ���ú�����Ũ�ȵĴ���ʽ��ʾ����
��4��ͨ���˹���������ܽ�ˮ��ȼú������CO2ת����HCOOH��O2����֪������0.1 mol��L��1��HCOONa��ҺpH =10����HCOOH�ĵ��볣��![]() =___________________��
=___________________��
���𰸡���1��-746.5 ��2����4.4��10-3 D ��22.2% 3.4 L/mol��3��2c(SO![]() )+c(HSO
)+c(HSO![]() )��4��1.0��10-7
)��4��1.0��10-7
��������
�����������1����N2��g��+O2��g���T2NO��g����H1=+180.5kJmol-1
��C��ȼ��������H��Ϊ-393.5kJmol-1���Ȼ�ѧ����ʽΪC��s��+O2��g��=CO2��g����H=-393.5kJmol-1����C0��ȼ����283kJmol-1 ���Ȼ�ѧ����ʽΪCO��g��+1/2 O2��g��=CO2��g����H=-283kJmol-1�����ݸ�˹���ɼ����ۡ�2-���õ���2NO��g��+2CO��g���TN2��g��+2CO2��g������H=-746.5KJ/mol������ͼ�����һ����̼Ũ�ȱ仯=0.10mol/L-0.06mol/L=0.04mol/L��CO��0-9min�ڵ�ƽ����Ӧ����v��CO��=0.04/9= 4.4��10-3����12minʱ��һ����̼��һ������Ũ�ȼ�С��Ũ������˵��ƽ��������У�A����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ��������У���A�����ϣ� B������NO��ƽ��������У�һ������Ũ�ȴ���ԭƽ�⣬��B�����ϣ�C���Ӵ����ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬��C�����ϣ� D����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ��������У���D���ϣ��ı�ķ�Ӧ���������ǽ����¶ȡ����÷�Ӧ�ڵ�24minʱ�ﵽƽ��״̬��ƽ��Ũ��c��N2��=0.03mol/L��c��NO��=0.14mol/L��c��CO��=0.04mol/L�����ݻ�ѧƽ������ʽ��ʽ����
2NO��g��+2CO��g���TN2��g��+2CO2��g��
��ʼ����mol/L�� 0.2 0.1 0 0
�仯����mol/L�� 0.06 0.06 0.03 0.06
ƽ������mol/L�� 0.14 0.04 0.03 0.06
CO2���������=0.06/��0.104+0.04+0.03+0.06��=22.2%��ƽ�ⳣ��K=��0.062��0.03��/��0.142��0.042��=3.4
��3�������е�SO2����ijŨ��NaOH��Һ���յõ�Na2SO3��NaHSO3�����Һ����������Һ�����ԣ�������Һ�е���غ������c��Na+��+c��H+��=2c��SO32-��+c��HSO3-��+c��OH-����c��H+��=c��OH-�����õ���Na+��=2c��SO32-��+c��HSO3-������4�������£�0.1mol/L��HCOONa��ҺpHΪ10����Һ�д���HCOO-ˮ��HCOO-+H2OHCOOH+OH-����Kh=��10-4��10-4��/��0.1-10-4��=10-7����HCOOH�ĵ��볣��Ka=Kw/Kh=10-14/10-7=1.0��10-7��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʮһ�����ѽ���Ϊ������֮��ĵ������������ҵ����������Ϊԭ���Ʊ��������Ѽ��ѵĹ�����������ͼ��ʾ�����������Ҫ�ɷ�Ϊ��������(FeTiO3)������һ������Ԫ���ڷ绯�����л�ת��Ϊ��3�ۣ�FeTiO3�������TiԪ����TiO2+���ڣ�TiOSO4��ˮ��ˮ�⡣
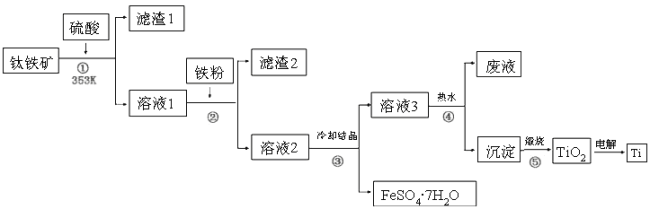
�����������Ϣ�ش��������⣺
��1�����м������۵�Ŀ����__________��
��2�����л��������������________(����ĸ���)��
a���ۡ��е���� b���ܽ��Բ��� c�������ԡ���ԭ�Բ���
��3�������������о���Ҫ���еIJ�����________(���������)��
��4��д���������ӷ���ʽ��_______________���ù�������ˮ�в�����Ŀ����_________
��5���������������еķ�Һ�����̿�(��Ҫ�ɷ�ΪMnO2)��Ӧ������������(MnSO4��������ˮ)���÷�Ӧ�����ӷ���ʽΪ_______________��
��6����ѧ�Ҵӵ��ұ�����Ĺ��յõ�����.�ҳ���ұ���ѵ��¹��ա�
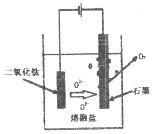
��ֱ�ӵ�����TiO2�������ѣ�ԭ����ͼ��ʾ������������ѵĵ缫��ӦΪ_____________��
�����һ��ʱ�����Ҫ����ʯī�缫��ԭ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Ԫ�����ʵĵݱ���ɣ���ƿ�����ϵ��ʵ�顣
������1�����ơ��ء�þ������1 mol�ֱ�Ͷ�뵽������0.1 mol��L��1�������У�д�������ᷴӦ�����Ľ���������Ӧ�����ӷ���ʽ___________________________________��
��2����NaOH��Һ��NH4Cl��Һ�������NH3��H2O���Ӷ���֤NaOH�ļ��Դ���NH3��H2O���̶�������֤Na�Ľ����Դ���N������Ϊ������Ƿ��������˵�����ɣ�________________________________��
����������ͼװ�ÿ�����֤�ǽ����Եı仯���ɡ�
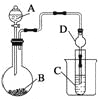 �����ȼ��г�����ʡ�ԣ�
�����ȼ��г�����ʡ�ԣ�
��3��ʵ�������ṩҩƷŨ���ᡢŨ���ᡢNa2S��Na2SiO3��MnO2��CaCO3����Ҫ֤���ǽ�����Cl>S��װ��A��B��C����װҩƷ�ֱ�Ϊ_________________________________��װ��C�е�ʵ������Ϊ�е���ɫ�������ɣ����ӷ���ʽΪ_____________________________________��
��4����Ҫ֤���ǽ����ԣ�S>C>Si����A�м�_________��B�м�Na2CO3��C�м�_________ ����۲�װ��C�е�ʵ������Ϊ�а�ɫ�������ɡ����ӷ���ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
�����ǹ�ҵ��������Ҫ�IJ�Ʒ֮һ���ںܶ���������Ҫ��;���ش��������⣺
��1�������Ṥҵ�����У��ҹ����û�����Ϊԭ������SO2����Ӧ�Ļ�ѧ����ʽΪ_________________���÷�Ӧ��___________________(���豸����)�н��С�
��2��Ϊ��������SO2ת��ΪSO3�����ܳ���������ܣ��ɲ������ж����������Ƚ�������______(���豸����)�н��з�Ӧ������ͼ��ʾ��װ���У�C��������������_______(���豸����)����______���գ��õ�Ũ����������ᡣ
��3��ʵ���ã�SO2����SO3��ת�������¶ȡ�ѹǿ�Ĺ�ϵ���±���ʾ����֪400��600�������Ĵ�Ч���Ϻã��������ʵ�ʣ�ѡ������ʵ�����������___________��

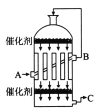
��4�������SO2�ķ�Ӧ���ʺ�ת���ʣ����д�ʩ���е���__________(��ѡ����ĸ)��
A����װ����ͨ�뵪���ұ���������� B����װ����ͨ���Թ��������ұ����������
C�����Ӹ���Ĵ��� D�������¶ȣ���ʱת��SO3
��5���������ų���β���У���SO2�ĺ�������500![]() L��L-1����Ҫ���Դ�������������֮һ���ð�ˮϴ������������������ˮ����β����SO2�Ļ�ѧ����ʽΪ__________________________________��
L��L-1����Ҫ���Դ�������������֮һ���ð�ˮϴ������������������ˮ����β����SO2�Ļ�ѧ����ʽΪ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�ΪV L���ܱ������н���aN(g)![]() bM(g)�ķ��ȷ�Ӧ��M��N���ʵ�����ʱ��ı仯������ͼ��ʾ��
bM(g)�ķ��ȷ�Ӧ��M��N���ʵ�����ʱ��ı仯������ͼ��ʾ��

��1���˷�Ӧ�Ļ�ѧ����ʽ����______��
��2��t2ʱ���߽����__ƽ��״̬(��ǡ����ǡ�)��v��__v��(����������� ����)��
��3���˷�Ӧ�ﵽƽ��ʱ����Ӧ���ת����Ϊ____________��
��4������������˵��������Ӧ�ﵽƽ��״̬����__________��
�ٷ�Ӧ��M��N���ʵ���֮��Ϊ2��5 �ڻ������������ʵ�������ʱ��ı仯���仯��M��ת���ʴﵽ��� ��������Ϊ������������ϵ���¶Ȳ��ٱ仯
IIij�¶�ʱ����1 mol N2O4����ͨ�����Ϊ10 L������ܱ������У��������ֺ���ɫ[��Ϊ����N2O4(��ɫ)![]() 2NO2(����ɫ)�ķ�Ӧ]����Ӧ����4 sʱ��NO2��Ũ��Ϊ0.04mol��L��1���پ���һ��ʱ���Ӧ�ﵽƽ��״̬����ʱ������ѹǿΪ��ʼʱ��1.8������
2NO2(����ɫ)�ķ�Ӧ]����Ӧ����4 sʱ��NO2��Ũ��Ϊ0.04mol��L��1���پ���һ��ʱ���Ӧ�ﵽƽ��״̬����ʱ������ѹǿΪ��ʼʱ��1.8������
��1��ǰ4 s��N2O4Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ ��
��2����4 sĩʱ�����ڵ�ѹǿ�ǿ�ʼʱ�� ����
��3��ƽ��ʱ������NO2��Ũ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������ͨ����������S8(б����)����ʽ���ڣ���������״̬ʱ������S2��S4��S6��S8�ȶ���ͬ�������壬����S4��S6��S8�������ƵĽṹ�ص㣬��ṹ����ͼ��ʾ��

�ش��������⣺
��1�������й�˵����ȷ���� ��
A.S2��S4��S6��S8��Ϊͬϵ�� B.S8ת��ΪS6��S4��S2���������仯
C.������������ӣ���ȫȼ��ʱ������SO2 D.���������µ�����Ϊԭ�Ӿ���
E.32gS8�������е�S��S������ΪNA
��2����һ���¶��£������������ƽ��Ħ������Ϊ80g/mol�����������S2���ӵ����������С�� ��
��3����һ�������£�S8(s)��O2(g)������Ӧ����ת��ΪSO2(g)��SO3(g)����Ӧ���̺�������ϵ������ͼ��ʾ(ͼ�е���H��ʾ����1mol���������)��

��д����ʾS8ȼ�յ��Ȼ�ѧ����ʽ_____________��
��д��SO3�ֽ�����SO2��O2���Ȼ�ѧ����ʽ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӳ�ȴ��۵�ߡ�������������������������һ����Ҫ�Ľṹ�մɲ��ϡ�һ���ù�ҵ�裨�������ء��ơ�����ͭ�����������֪����۵���1420����������������ˮ���������Ը�ʴ�����衣һ�ֺϳɵ�����Ĺ����������£�
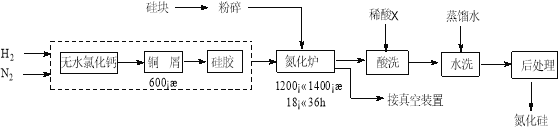
��1������N2��H2ʱ��ͭм�������ǣ� ���轺�������� ��
��2���ڵ���¯��3SiO2(s)+2N2(g)=Si3N4(s) ��H=��727.5kJ/mol����ʼʱΪʲôҪ�ϸ���Ƶ����������Կ����¶��� ����ϵ��Ҫͨ��������������Ϊ�� ��
��3��X������ ��ѡ������ᡱ�������ᡱ�������ᡱ��������ᡱ����
��4�����˵���������Ʒ����ˮϴ�ɾ��� ��
��5���ù������Դ���������ƣ�NaN3������Դ��ֱ��ȼ�����ɵ����裨�����û���Ӧ�����÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ����ѧ�����ѡ��1����ѡ���⣬
��һ����������Ѽ������������������Ѽ�ײ͵IJ���ԭ�����£��� Ѽ�⡢�� ��ۡ��� �ƹϡ��� ʳ�Ρ���ش�
��1���������۵��� ������ţ���ͬ������2�����������ʵ��� ��
��3������ά���ص��� �� ��4�����ڵ�ζ������ ��
��������������������������ͷ�չ����Ҫ���ʻ�����
��1���Թܡ��ձ�����ƿ�Ȼ�ѧ��������Ҫ������ ��
A������ B���մ�
��2��������Ŀǰ�����������Ͻ𡣸����Ӵ���ˮ�����绯ѧ��ʴ���为����ӦʽΪ ��
A��O2+2H2O + 4e- = 4OH- B��Fe - 2e -= Fe2+
������������ˮ��Ҫ��Դ���ȼҵ�����Ϲ�ҵ��δ�����������ŷš�ij�������Է�ˮ����Ҫ��Hg2+��H+��Na+��Cl���ȣ��Ĵ���������������ͼ��ʾ��
 ��ش�
��ش�
��1��������ˮδ������ֱ���ŷŵ�Σ���� ������ĸ����
a. ���ˮ����Ⱦ b. ���������ж�
��2�����ڷ�ˮpHʱ�������ҺA������ ������ĸ����
a. ���� b. NaOH��Һ
��3��Na2S��Hg2+������Ӧ�����ӷ���ʽ�� ��
��4���÷�ˮ����������й��������£��������Ӻ��Բ��ƣ���
���� | Na+ | Fe2+ | Cl�� | SO42�� |
Ũ�ȣ�mol/L�� | 3.0��10-4 | 2.0��10-4 | 2.5��10-4 |
��c(Fe2+) = mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����ͬλ�ص��ǣ�����ţ���ͬ�� ������ͬ����������� ����Ϊͬϵ����� ������ͬ���칹����� ������ͬ�����ʵ��� ��
A��O2��O3 B.D��T C.![]()
D.![]() E.
E.

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com