
【题目】[化学——选修2:化学与技术]
硫酸是工业生产中重要的产品之一,在很多领域都有重要用途。回答下列问题:
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为_________________;该反应在___________________(填设备名称)中进行。
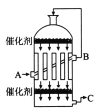
(2)为了有利于SO2转化为SO3,且能充分利用热能,可采用在有多层催化剂且有热交换器的______(填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有_______(填设备名称)中用______吸收,得到浓硫酸或发烟硫酸。
(3)实验测得:SO2生成SO3的转化率与温度、压强的关系如下表所示。已知400~600℃催化剂的催化效果较好,结合生产实际,选择最合适的生产条件是___________。

(4)欲提高SO2的反应速率和转化率,下列措施可行的是__________(填选项字母)。
A.向装置中通入氮气且保持体积不变 B.向装置中通入稍过量氧气且保持体积不变
C.添加更多的催化剂 D.降低温度,及时转移SO3
(5)吸收塔排出的尾气中,若SO2的含量超过500![]() L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
L·L-1,就要加以处理,处理方法之一是用氨水洗涤烟气脱硫,用足量氨水吸收尾气中SO2的化学方程式为__________________________________。
【答案】(1)4FeS2+11O2 ![]() 2Fe2O3+8SO2 沸腾炉 (2)接触室;SO2、SO3、O2;吸收塔;98.3%的H2SO4
2Fe2O3+8SO2 沸腾炉 (2)接触室;SO2、SO3、O2;吸收塔;98.3%的H2SO4
(3)400℃,1个标准大气压 (4)B (5)2NH3H2O+SO2=(NH4)2SO3+H2O
【解析】
试题分析:(1)黄铁矿的主要成分为4FeS2,煅烧时与O2反应生成Fe2O3和SO2,化学方程式为:4FeS2+11O2 ![]() 2Fe2O3+8SO2;黄铁矿煅烧的设备是沸腾炉。
2Fe2O3+8SO2;黄铁矿煅烧的设备是沸腾炉。
(2)SO2转化为SO3在接触室中进行;SO2与O2的反应为可逆反应,所以C处流出的气体有:SO2、SO3、O2;为了防止酸雾的形成,用98.3%的H2SO4吸收SO3,吸收SO3的设备是吸收塔。
(3)因为SO2与O2的反应是放热反应,所以选择的温度为400℃,而1个标准大气压时SO2的转化率已经很大,再增大压强,SO2的转化率提高不大,但会增加生产成本,所以选择1个标准大气压。
(4)A.向装置中通入氮气且保持体积不变,二氧化硫的浓度不变,反应速率不变,转化率也不变,A错误;B.向装置中通入稍过量氧气且保持体积不变,反应速率加快,平衡向正反应方向进行,二氧化硫转化率增大,B正确;C.添加更多的催化剂改变反应速率,但不能改变平衡状态,C错误;D.降低温度,及时转移SO3,平衡向正反应方向进行,但反应速率减小,D错误,答案选B。
(5)SO2为酸性氧化物,与碱反应生成盐和水,化学方程式为:2NH3H2O+SO2=(NH4)2SO3+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】恒温下,容积为2L的定容密闭容器中,充入3molA、ymolB,发生反应:3A(g)+2B(g)![]() 2C(g)+xD(g)。2min后达到平衡,测得从反应开始到平衡时C的速率为0.3mol·L-1·min-1.下列推断的结论正确的是
2C(g)+xD(g)。2min后达到平衡,测得从反应开始到平衡时C的速率为0.3mol·L-1·min-1.下列推断的结论正确的是
A.y![]() 1.2
1.2
B.增大反应体系的压强,反应速率不一定增大
C.v正(A)>v逆(C),不可能为平衡状态
D.混合气体的密度不再变化,一定为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某容积可变的密闭容器中进行反应:C(s)+H2O(g)![]() CO(g)+H2(g)。下列说法或结论不成立的是
CO(g)+H2(g)。下列说法或结论不成立的是
A.当体系的体积不再发生变化,该反应已建立平衡
B.达到平衡后向体系中充入少量He,平衡不移动
C.增大水蒸气的用量可以提高碳粉的转化率
D.若断裂1 molH-H键的同时断裂2molH-O键,则反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如图所示:

回答下列问题:
(1)A的名称是_____________。I含有官能团的名称是__________________。
(2)⑤的反应类型是________________,⑧的反应类型是________________。
(3)写出反应②的化学方程式:______________________________________。
(4)D分子中最多有_____________个原子共平面。E的结构简式为__________________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:__________________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
 ________________________(无机试剂及溶剂任选)。
________________________(无机试剂及溶剂任选)。
合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NCl3可用于漂白,也可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,有刺激性气味,可与水反应。实验室中可用氯气和氨气反应制取NCl3,反应方程式为4NH3+3C12===NCl3+3NH4Cl。某校化学兴趣小组同学设计了如图所示的实验装置(NH4Cl的分解温度为300℃左右)。
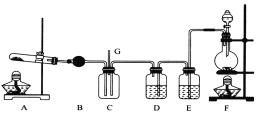
回答下列问题:
(1)写出装置F中的烧瓶内发生反应的离子方程式:___________________________。
(2)E中的试剂为__________________。
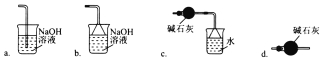
(3)导管G末端应连接的装置为下图中的___________(填选项字母)。
(4)NCl3遇水可发生水解反应生成两种物质,其中一种是可使湿润的红色石蕊试纸变蓝的气体,写出NCl3水解的化学方程式:_______________。
(5)已知C中生成的NH4Cl溶解在NCl3中,欲将二者分离可采取的操作方法为_____________________。
(6)NH4Al(SO4)2也可用于自来水的净化。
①NH4Al(SO4)2溶液中离子浓度由大到小的顺序为_________________。
②向NH4Al(SO4)2溶液中滴加氨水至溶液呈中性,在此过程中水的电离程度_________(填“增大”“减小”或“不变”)。
③常温下,将a mol NH4Al(SO4)2:加入到b L c mol/L的氨水中,所得溶液呈中性,此时溶液中c(Al3+)≈0 mol/L,计算该温度下NH3·H2O的电离常数___________(用含字母的代数式表示,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g) ![]() 2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的△H = kJ·mol-1
N2(g) + 2CO2(g)的△H = kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=_______________ mol·L﹣1·min﹣1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为__________(保留三位有效数字),化学平衡常数K=___________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol·L﹣1的HCOONa溶液pH =10,则HCOOH的电离常数![]() =___________________。
=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
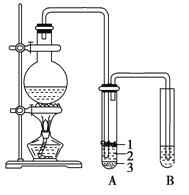
(1)圆底烧瓶中加入的反应物是溴化钠、______________、和1∶1的硫酸。配制体积比1∶1的硫酸所用的定量仪器为______________(选填编号)。
a.天平 b.量筒 c.容量瓶 d.碱式滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式________________________________________________,________________________________________________。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________________________________________________________________________。
试管A中的物质分为三层(如图所示),产物在第________________层(填序号)。
(4)试管A中除了产物和水之外,还可能存在___________、___________(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是___________(选填编号)。
a.蒸馏 b.用氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是______________。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)②2M(g)
2Z(g)②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。下列判断正确的是:

A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时X的转化率为5/11
D.在平衡(I)和平衡(II)中M的体积分数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com