
【题目】一定温度下,在容积为V L的密闭容器中进行aN(g)![]() bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中=______。
(2)t2时两线交叉点__平衡状态(填“是”或“不是”),v正__v逆(填“>”“<” 或“=”)。
(3)此反应达到平衡时,反应物的转化率为____________。
(4)下列描述能说明上述反应达到平衡状态的是__________。
①反应中M与N物质的量之比为2∶5 ②混合气体的总物质的量不随时间的变化而变化③M的转化率达到最大 ④如容器为绝热容器,体系内温度不再变化
II某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色[因为发生N2O4(无色)![]() 2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
(1)前4 s以N2O4浓度变化表示的平均反应速率为 。
(2)在4 s末时容器内的压强是开始时的 倍。
(3)平衡时容器内NO2的浓度是 。
【答案】I(1)2 (2)不是 > (3)75%(4)②③④
Ⅱ(1)0.005 mol·L-1·s-1 (2)1.2倍(3)0.16 mol·L-1
【解析】
试题分析:I、(1)参加反应的N的物质的量为8mol-2mol=6mol,生成的M的物质的量是5mol-2mol=3mol,所以此反应的化学方程式中a/b=2:1;
(2)t2时M、N的物质的量相等,但二者的物质的量仍然是变化的,因此两线交叉点不是平衡状态;此时反应物的物质的量仍然在减少,生成物的物质的量仍然在增加,因此反应向正反应方向进行,则v正>v逆。
(3)由图可知,N为反应物,N的起始物质的量为8mol,平衡时参加反应的N的物质的量为8mol-2mol=6mol,故N的转化率为![]() ×100%=75%;
×100%=75%;
(4)①反应中M与N物质的量之比为2∶5并不能说说明正逆反应速率相等,则不一定是处于平衡状态,①错误;②由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不随时间的变化而变化,说明到达平衡,②正确;③M的转化率达到最大时说明反应达到平衡状态,③正确;④如容器为绝热容器,体系内温度不再变化说明反应达到限度,④正确,答案选②③④。
Ⅱ、(1)前4 sNO2表示的反应速率是0.04mol/L÷4s=0.01 mol·L-1·s-1,反应速率之比是化学计量数之比,则以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1÷2=0.005 mol·L-1·s-1。
(2)在4 s末时生成NO2是0.04mol/L×10L=0.4mol,则根据方程式可知消耗N2O4是0.2mol,剩余N2O4是0.8mol,因此容器内的压强是开始时的![]() 倍。
倍。
(3) N2O4(无色)![]() 2NO2(红棕色)
2NO2(红棕色)
起始量(mol) 1 0
转化量(mol) x 2x
平衡量(mol) 1-x 2x
平衡时容器内压强为开始时的1.8倍,则![]() ,解得x=0.8,所以平衡时容器内NO2的浓度是1.6mol÷10L=0.16mol/L。
,解得x=0.8,所以平衡时容器内NO2的浓度是1.6mol÷10L=0.16mol/L。


科目:高中化学 来源: 题型:
【题目】自然界中金属硫化物之间存在原电池反应。下图所示装置中电极Ⅰ为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转。若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀。下列有关说法中正确的是( )

A.工业上利用该原理富集铁
B.电极Ⅱ作正极
C.溶液流经该装置后pH增大
D.该装置负极的电极反应为FeS2—15e—+8H2O=Fe3++2SO42—+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—-选修2:化学与技术】
甘氨酸亚铁络合物[化学式为(NH2CH2COO)2Fe]是常用的补铁剂,其合成方法如下:
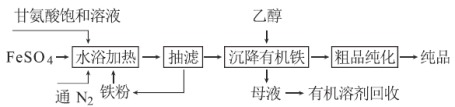
(1)通入N2的作用是 。
(2)已知甘氨酸显弱酸性,其结构简式为NH2CH2COOH,甘氨酸亚铁络合物易溶于水且在水中难电离,写出“水浴加热”过程中生成甘氨酸亚铁络合物的反应的离子方程式 。
(3)抽滤的好处是 ,从“母液”中回收有机溶剂的方法是 。
(4)“粗品纯化”的操作为蒸馏水洗涤、 洗涤、干燥,其中干燥过程使用的设备最好选用 (填“常压干燥机”或“真空干燥机”)。
(5)有文献指出,若在“水浴加热”过程中投入适量的石灰石,则能同时提高产品的产率和纯度,请解释原因: 。
(6)若甘氨酸的投料量为300 kg,产出纯品346.8 kg,则产率为 。(甘氨酸的相对分子质量为75)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如图所示:

回答下列问题:
(1)A的名称是_____________。I含有官能团的名称是__________________。
(2)⑤的反应类型是________________,⑧的反应类型是________________。
(3)写出反应②的化学方程式:______________________________________。
(4)D分子中最多有_____________个原子共平面。E的结构简式为__________________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:__________________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
 ________________________(无机试剂及溶剂任选)。
________________________(无机试剂及溶剂任选)。
合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2的离子化合物。
(1)写出Y2O2的电子式:____ _,其中含有的化学键是___ _。
(2)用电子式表示Y2O的形成过程________ _______。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶浓氧化性最强的是_____(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是__________(填化学式)。
(5)由X、Y组成的化合物分子中.X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式_______________ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g) ![]() 2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的△H = kJ·mol-1
N2(g) + 2CO2(g)的△H = kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=_______________ mol·L﹣1·min﹣1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为__________(保留三位有效数字),化学平衡常数K=___________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol·L﹣1的HCOONa溶液pH =10,则HCOOH的电离常数![]() =___________________。
=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】奥沙拉秦是种抗菌药。其合成路线如下:

已知:①NaNO2具有强氧化性
 ②
②
(1)水杨酸中所含官能团的名称是___________。
(2)A的分子式是___________。
(3)B→C的化学方程式___________。
(4)整个合成路线看,设计B→C步骤的作用是___________。
(5)D的结构简式是___________。D→E的反应类型是___________。
(6)有机物G(结构简式见右上图)也可用于合成奥沙拉秦。它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有_____种,写出一种X可能的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物B是一种相对分子质量不超过120的芳香烃含氧衍生物,期中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应
A+H2O B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示:

已知:![]()
根据以上信息,回答下列问题:
(1)B的结构简式为 ,条件I、II中均需要的试剂为 。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有 个。
(3)C的同分异构体中,同时符合下列要求的物质有 种。
a.苯环上有两个侧链 b.能发生银镜反应 c.能发生消去反应
(4)写出F→E转化的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
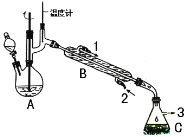
【题目】在有机反应中加氧去氢的反应叫氧化反应,去氧加氢的反应叫还原反应,如乙烯与氢气的加成反应也叫还原反应。1-苯乙醇因具有玫瑰香气味而广泛用于各种食用香精中,实验室用苯乙酮制备1-苯乙醇的反应、装置示意图和有关数据如下:

试剂[ | 熔点/℃[ | 沸点/℃ | 密度/g·cm-3 | 溶解性 | ||
水 | 乙醇 | 乙醚 | ||||
1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
硼氢化钠 | 36 | 400 | 1.076 | 溶 | 溶 | 不溶 |
乙醇 | -117.3 | 78.4 | 0.789 | 溶 | - | 溶 |
乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |
实验步骤:
在A中加入15mL 95%的乙醇和1.0g硼氢化钠,搅拌下再滴入8mL苯乙酮,然后在搅拌的条件下,滴加足量的3mol·L-1的盐酸;使A中反应液的温度保持在75-80℃,使其中大部分乙醇蒸发,出现分层,再加入10mL乙醚。将混合反应液倒入分液漏斗中分液,水层再用10mL乙醚萃取,合并两次有机相,再进行简单蒸馏除去乙醚。最后经提纯收集到1-苯乙醇4.5g。
回答下列问题:
(1) 苯乙酮制备1-苯乙醇的反应类型是 ;
(2)仪器B的名称为______________;
(3)反应完成后,加入10mL乙醚,充分振荡后,上层为__________(填“水层”或“有机层”)
(4)反应中加入乙醇的目的是________________________________;
(5)两次合并的有机相进行蒸馏除去乙醚,采用的最佳加热方式是_________(填字母),若回收乙醚,则收集馏分的温度范围是____________________;
a.酒精为加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热
(6)本实验的产率为_____________(保留两位有效数字)。
(7) 1-苯乙醇除用作香料外也用于有机合成,如1-苯乙醇与冰醋酸酯化反应制得乙酸苏合香酯,写出此反应化学反应方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com