
【题目】下列叙述中正确的是( )
A. 铜作阳极电解稀硫酸制H2、O2
B. 用电解法精炼粗铜时粗铜作阴极
C. 在镀件上电镀铜时可用镀件作阳极
D. 实验室欲加速制取氢气,可采用含少量铜的粗锌跟稀硫酸反应
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是

A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置进行中和热测定实验,请回答下列问题:

(1)仪器A的名称为_______。
(2)大小烧杯之间填满碎泡沫塑料的作用是__________。
(3)实验中若用0.50mol·L-1H2SO4溶液跟0.50mol·L-1NaOH溶液进行中和热测定,写出表示该反应中和热的热化学方程试(中和热为57.3kJ·mol-1):__________________。
(4)取30mL0.50mol·L-1 H2SO4溶液与50mL0.50mol·L-1 NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高4.1℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=_____,
(5)上述实验数值结果与57.3 kJ/mol有偏差,产生此偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
(6)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”.“不相等”),所求中和热___(填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会____(填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 两种气体A与B的相对分子质量之比为m∶n
B. 同质量气体A与B的分子数之比为n∶m
C. 同温同压下,A、B两气体的密度之比为n∶m
D. 相同状况下,同体积A、B两气体的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。下列说法一定正确的是( )

A.一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+
B.一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+
C.溶液中c(H+):c(Al3+):c(Mg2+)=1:1:2
D.溶液中c(H+)/c(SO42-)![]() 2/9
2/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为C6H6的结构有多种,其中的两种为:
![]()
①这两种结构的区别表现在定性方面(即化学性质方面):Ⅱ能_____(填入编号,下同),而Ⅰ不能_____。
A.被酸性高锰酸钾溶液氧化 B.与溴水发生加成反应
C.与溴发生取代反应 D.与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成,Ⅰ需_____mol,而Ⅱ需_______mol。
②今发现C6H6还可能有另一种如图所示的立体结构,该结构的二氯代物有___________种。
![]()
(2)已知萘的结构简式为![]() ,该结构简式不能解释萘的下列_______事实(填编号)。
,该结构简式不能解释萘的下列_______事实(填编号)。
A.萘不能使酸性高锰酸钾溶液褪色
B.萘能与H2发生加成反应
C.萘分子中所有原子在同一平面上
D.一溴代萘(C10H7Br)只有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制100mL 0.10molL﹣1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解;
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中;
操作3:继续向X中加蒸馏水至液面离X的刻度线l~2cm处;
操作4、操作5:见图
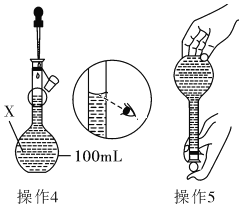
(1)仪器X的名称是______________;
(2)操作1中,应称取胆矾晶体的质量为_____________;
(3)若其余操作步骤均正确,根据操作4所配的溶液浓度__(选填“偏大”、“偏小”、“无影响”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定体积的密闭容器中,进行下列化学反应: ![]()
![]()
![]() 其化学平衡常数K和温度T的关系如下表:
其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列有关叙述不正确的是 ( )
A. 该反应为吸热反应
B. 可测量容器总压变化来判定化学反应是否达到平衡
C. 若在某平衡状态时,c(CO2)·c(H2)=c(CO)·c(H2O),此时的温度为830℃
D. 若平衡时两种反应物的转化率相等,则起始投入时n(CO2):n(H2)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“ 0”或“0”刻度线稍下,并记下读数;④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴甲基橙溶液;⑤用标准液滴定至终点,记下滴定管液面读数。⑥重复以上滴定操作2-3次。请回答:
(1)以上步骤有错误的是(填编号)____________________
(2)步骤④中,量取20.00 mL待测液应使用_________________(填仪器名称)
(3)步骤⑤滴定时眼睛应注视______________________________;判断到达滴定终点的依据是:______________________________________。
(4)以下是实验数据记录表
滴定 次数 | 盐酸体积 (mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.20 |
3 | 20.00 | 0.00 | 16.16 |
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是__________
A. 锥形瓶装液前,留有少量蒸馏水 B. 滴定结束时,仰视读数
C.滴定前滴定管尖嘴无气泡,滴定结束有气泡 D.锥形瓶用待测液润洗
E. NaOH标准液保存时间过长,有部分变质
(5)根据表中记录数据,通过计算可得,该盐酸浓度为: ____________mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com