
【题目】在一定温度下,向容积固定不变的密闭容器里充入a mol NO2,发生如下反应:2NO2(g)![]() N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
A.平均相对分子质量增大 B.NO2的转化率提高
C.压强为原来的2倍 D.颜色变深
【答案】C
【解析】
试题解析:达平衡后再向容器中充入amol NO2,再次达到平衡后,等效为在原平衡的基础上压强增大1倍,平衡右移,NO2的转化率增大,A.等效为在原平衡的基础上压强增大1倍,平衡右移,NO2的转化率增大,混合气体的物质的量减小、总的质量不变,故混合气体的相对平均分子质量增大,故A正确;B.等效为在原平衡的基础上压强增大1倍,平衡右移,NO2的转化率增大,故B正确;C、平衡正向移动,混合气体的物质的量减小,压强比原来的2倍小,故C错误;D、达平衡后再向容器中充入amol N2O4,再次达到平衡后,等效为在原平衡的基础上增大压强,二氧化氮的浓度增大,平衡混合气的颜色变深,故D正确。


科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、创新利用是世界能源领域的一个重要战略方向。
(1)用稀氨水喷雾捕集CO2。常温下,用氨水吸收CO2可得到NH4HCO3溶液。已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11。在NH4HCO3溶液中,c(NH4+)___________(填“>”“<”或“=”)c(HCO3-);NH4HCO3溶液中物料守恒表达式为________。
(2)CO2经催化加氢可合成低碳烯烃,合成乙烯的反应为2CO2(g)+6H2(g)C2H4(g)+4H2O(g) △H。向1 L恒容密闭容器中充入2 mol CO2(g)和n mol H2(g),在一定条件下发生该反应。CO2的转化率与温度、投料比[ ]的关系如图所示:
]的关系如图所示:

①该反应的△H_______0(填“>”“<“或“=”)。
②图中x1________(填“<”“>”或“=”)x2。
③若图中B点的投料比为2,则500℃时的平衡常数KB=________。
(3)工业上用CO2生产甲醇燃料,进一步可合成二甲醚。已知:298K和101kPa条件下,
反应I:CO2(g)+3H2(g)CH3OH(g)+H2O(l) △H=—a kJ·mol-1
反应II:2H2(g)+O2(g)2H2O(1) △H=-b kJ·mol-1
反应III:CH3OH(g)CH3OH(l) △H=-c kJ·mol-1
①CH3OH(l)燃烧热的热化学方程式为_________。
②合成二甲醚的总反应为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H=-130.8 kJ·mol-1。在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、1.01×105Pa下,将22gCO2通入750mL1mol·L-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知在该条件下,1molCO2通入1L2mol·L-1NaOH溶液中充分反应放出ykJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D.CO2(g)+NaOH(l)=NaHCO3(l) ΔH=-(8x-2y) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照以下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2%H2O2溶液 | 无 |
② | 10mL5%H2O2溶液 | 无 |
③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1。分析图1能够得出的实验结论是__。

(3)加入0.1gMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示。反应速率变化的原因是__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-a kJ·mol-1
途径Ⅱ:C3H8(g)―→C3H6(g)+H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+9O2(g)===6CO2(g)+6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=-d kJ·mol-1 (a、b、c、d均为正值)
请回答下列问题:
(1)由于C3H8(g)→C3H6(g)+H2(g)的反应中,反应物具有的总能量________(填“大于”、“小于”或“等于”)生成物具有的总能量,那么在化学反应中,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物,因此其反应条件是__________。
(2)按途径Ⅱ反应,1 mol C3H8完全燃烧时放出的热量为________ kJ(用含b、c、d的代数式表示),等量的丙烷通过两种途径完全燃烧时,途径Ⅰ放出的热量________(填“大于”、“小于”或“等于”)途径Ⅱ放出的热量。
(3)a与b、c、d的数学关系式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不属于盐类水解应用的是( )
A.纯碱溶液去油污
B.草木灰与铵态氮肥不能混合施用
C.浓的硫化钠溶液有臭味
D.实验室用Zn和稀H2SO4制氢气时加入少量CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH1=-131.0kJ·mol-1
CH3OH(l)+H2O(l) ΔH1=-131.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1
则CH3OH的燃烧热ΔH=__。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g)![]() CH3COOH(g) ΔH=+36.0kJ·mol-1
CH3COOH(g) ΔH=+36.0kJ·mol-1
欲使乙酸的平衡产率提高,应采取的措施是__(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g)![]() 2CO(g)。
2CO(g)。
①该反应的平衡常数表达式K=__。
②向容积为1L的恒容容器中加入足量的碳和0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。
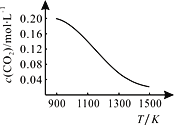
则该反应为__(填“放热”或“吸热”)反应。某温度下,若向该平衡体系中再通入0.2molCO2,达到新平衡后,体系中CO的百分含量__(填“变大”或“变小”或“不变”),平衡常数__(填“变大”或“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
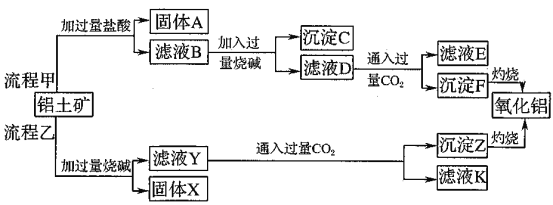
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为_________.
(2)流程乙加入烧碱后生成SiO32-的离子方程式为________.
(3)验证滤液B含![]() ,可取少量滤液并加入________(填试剂名称)。
,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________
(5)已知298K时,![]() 的容度积常数
的容度积常数![]() =5.6×
=5.6×![]() ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的![]() =_______.
=_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com