
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照以下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2%H2O2溶液 | 无 |
② | 10mL5%H2O2溶液 | 无 |
③ | 10mL5%H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是___。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1。分析图1能够得出的实验结论是__。

(3)加入0.1gMnO2粉末于50mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示。反应速率变化的原因是__。

【答案】探究H2O2溶液浓度的变化对分解速率的影响 FeCl3对H2O2的分解有催化作用,碱性条件比酸性条件催化效果好 H2O2的浓度逐渐减小
【解析】
本题主要考查影响化学反应速率的因素。
(1)为了便于比较,应在相同的条件下利用一个变量来比较,实验①和②的浓度不同;
(2)由图可知,⑤的反应速率最大,④的反应速率最小;
(3)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小。
(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响,
故答案为:探究浓度对反应速率的影响;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知均存在催化剂,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,故答案为:FeCl3对H2O2的分解有催化作用,碱性条件比酸性条件催化效果好;
(3)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:![]() ,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小。
,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小。
故答案为:H2O2的浓度逐渐减小。


科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数Kw=___;
(2)该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=___,此时该溶液中由水电离的c(OH-)=___mol/L。
(3)室温下,pH=3的硫酸溶液和pH=11的NaOH溶液等体积混合后,混合溶液的pH___(填>7、=7、<7);pH=3的醋酸溶液和pH=11的NaOH溶液等体积混合后,混合溶液的pH___(填>7、=7、<7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1,下列叙述正确的是( )
A.4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ
B.平衡时v正(O2)=![]() v逆(NO)
v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为___。
(2)以上述电池为电源,通过导线连接成图一电解池。

①若X、Y为石墨,a为2L0.1mol/LKCl溶液,写出电解总反应的离子方程式___。
②若X、Y分别为铜、银,a为1L0.2mol/LAgNO3溶液,写出Y电极反应式___。
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。

①结合图二计算,上述电解过程中消耗一氧化碳的质量为___g。
②若图二的B点pH=7,则滴定终点在___区间(填“AB”、“BC”或“CD”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g),下列叙述错误的是
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向容积固定不变的密闭容器里充入a mol NO2,发生如下反应:2NO2(g)![]() N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
A.平均相对分子质量增大 B.NO2的转化率提高
C.压强为原来的2倍 D.颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向含有等物质的量浓度的![]() 、NaOH混合物中滴加稀盐酸至过量,其中主要含碳物质
、NaOH混合物中滴加稀盐酸至过量,其中主要含碳物质![]() 、
、![]() 、
、![]() 的分布分数
的分布分数![]() 平衡时某物质的浓度占各物质浓度之和的分数
平衡时某物质的浓度占各物质浓度之和的分数![]() 与滴加盐酸体积的关系如图所示
与滴加盐酸体积的关系如图所示![]() 忽略滴加过程
忽略滴加过程![]() 气体的逸出
气体的逸出![]() 。下列说法不正确的是( )
。下列说法不正确的是( )

A.曲线B表示![]()
B.在滴加盐酸过程中溶液中![]() 与含碳各物质浓度的大小关系:
与含碳各物质浓度的大小关系:![]()
C.X、Y为曲线的两交叉点,若能知道X点处的pH就可以计算出![]() 的
的![]() 的值
的值
D.溶液中X、Y两点水电离出的![]() :
:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000mol·L-1 NaOH溶液滴定 20.00mL0.1000mol·L-1某一元酸HA溶液,滴定曲线如图。下列说法正确的是( )
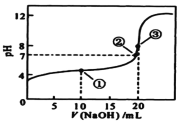
A. HA是强电解质
B. 点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C. 点②所示溶液中:c(Na+) =c(HA) +c(A-)
D. 水的电离程度随着NaOH溶液的滴入,不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2A(g)![]() B(g)+C(g)的平衡常数为1,在容积为2 L的密闭容器中加入A(g)。20 s时测得各组分的物质的量如下表:
B(g)+C(g)的平衡常数为1,在容积为2 L的密闭容器中加入A(g)。20 s时测得各组分的物质的量如下表:
物 质 | A(g) | B(g) | C(g) |
物质的量/mol | 1.2 | 0.6 | 0.6 |
下列说法正确的是( )
A. 反应前20 s的平均速率为v(A)=0.6 mol·L-1·s-1
B. 20 s时,正反应速率等于逆反应速率
C. 达平衡时,A(g)的转化率为100%
D. 若升高温度,平衡常数变为0.6,则反应的ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com