
����Ŀ����t��ʱ��ijNaOHϡ��Һ�У�c(H+)=10-amol/L��c(OH-)=10-bmol/L����֪a+b=12����
��1�����¶��£�ˮ�����ӻ�����Kw=___��
��2�����¶��£���100mL0.1mol/L��ϡ������100mL0.4mol/L��NaOH��Һ��Ϻ���Һ��pH=___����ʱ����Һ����ˮ�����c(OH-)=___mol/L��
��3�������£�pH=3��������Һ��pH=11��NaOH��Һ�������Ϻ����Һ��pH___����>7��=7��<7����pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������Ϻ����Һ��pH___����>7��=7��<7����
���𰸡�1��10-12 11 1��10-11mol/L =7 <7
��������
��t��ʱ��ijNaOHϡ��Һ�У�c(H+)=10-amol/L��c(OH-)=10-bmol/L����֪a+b=12����
��1�����¶��£�ˮ�����ӻ�����Kw= c(H+) c(OH-)���������ݣ��������Kw��
��2�����¶��£���100mL0.1mol/L��ϡ������100mL0.4mol/L��NaOH��Һ��Ϻ����Һ�У�c(OH-)=![]() ������Kw�������Һ�е�c(H+)���Ӷ������Һ��pH����ʱ����Һ����ˮ�����c(OH-)= c(H+)��
������Kw�������Һ�е�c(H+)���Ӷ������Һ��pH����ʱ����Һ����ˮ�����c(OH-)= c(H+)��
��3�������£�pH=3��������Һ��pH=11��NaOH��Һ�����(����Ϊ1L)��Ϻ�������������n(H+)=10-3mol/L��1L=10-3mol��NaOH���������n(OH-)=10-3mol/L��1L=10-3mol�����߸պ���ȫ��Ӧ�������Һ�����ԣ�pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������Ϻ���ȻH+��OH-�����ʵ���Ҳ��ȣ������ڴ�����Һ�д��ڴ���δ����Ĵ��ᣬ���Է�Ӧ�������ʣ�࣬��������ʹ��Һ�����ԡ�
��t��ʱ��ijNaOHϡ��Һ�У�c(H+)=10-amol/L��c(OH-)=10-bmol/L����֪a+b=12����
��1�����¶��£�ˮ�����ӻ�����Kw= c(H+) c(OH-)=10-a10-b=10-(a+b)=10-12����Ϊ��1��10-12��
��2�����¶��£���100mL0.1mol/L��ϡ������100mL0.4mol/L��NaOH��Һ��Ϻ����Һ�У�c(OH-)=![]() ������Kw�������Һ�е�c(H+)=
������Kw�������Һ�е�c(H+)=![]() =10-11mol/L���Ӷ������Һ��pH=11����ʱ����Һ����ˮ�����c(OH-)= c(H+)=10-11mol/L����Ϊ��11��1��10-11mol/L��
=10-11mol/L���Ӷ������Һ��pH=11����ʱ����Һ����ˮ�����c(OH-)= c(H+)=10-11mol/L����Ϊ��11��1��10-11mol/L��
��3�������£�pH=3��������Һ��pH=11��NaOH��Һ�����(����Ϊ1L)��Ϻ�������������n(H+)=10-3mol/L��1L=10-3mol��NaOH���������n(OH-)=10-3mol/L��1L=10-3mol�����߸պ���ȫ��Ӧ�������Һ�����ԣ�pH=7��pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������Ϻ���ȻH+��OH-�����ʵ���Ҳ��ȣ������ڴ�����Һ�д��ڴ���δ����Ĵ��ᣬ���Է�Ӧ�������ʣ�࣬��������ʹ��Һ�����ԣ�pH<7����Ϊ��=7��<7��


 �ŵ������ϵ�д�
�ŵ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�Ҷ�һ̼��ѧ�����˹㷺������о���ȡ����һЩ��Ҫ�ɹ���
��1����֪��CO(g)+2H2(g) ![]() CH3OH(g) ��H1����90.0kJ/mol��
CH3OH(g) ��H1����90.0kJ/mol��
3CH3OH(g) ![]() CH3CH=CH2(g)+3H2O(g) ��H2����31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) ��H2����31.0kJ/mol
CO��H2�ϳ�CH3CH=CH2���Ȼ�ѧ����ʽΪ________��
��2���״���CH3OH������Ϊ������������ȼ�ϣ���ҵ�Ͽ���CO�� H2�ڴ��������ºϳɼ״����������Ϊ2L�ĺ��ݾ����ܱ������У�����1molCO ��2mo1H2������Ӧ��CO(g)+2H2(g) ![]() CH3OH(g) ��H1��-90.0kJ/mol������Ӧ���е�5minʱ�ﵽƽ��״̬����ʱCH3OH�����ʵ���Ϊ0.6mol����
CH3OH(g) ��H1��-90.0kJ/mol������Ӧ���е�5minʱ�ﵽƽ��״̬����ʱCH3OH�����ʵ���Ϊ0.6mol����
��5 min�ڷ�Ӧ��ƽ��������(H2) = _____ mol/(L��min)��
�ڴﵽƽ��ʱ�ų�������Ϊ________ kJ
�۲���˵���÷�Ӧ�Ѵﵽƽ��״̬����____��ѡ����ĸ��ţ�
a��CO�����ʵ������ٸı� b���������¶ȱ��ֲ���
c��CH3OH����������������������� d�������ڵ��ܶȱ��ֲ���
��3��һ�ּ״�ȼ�ϵ����ͼ��ʹ�õĵ������Һ��2mol��L��1��KOH��Һ��
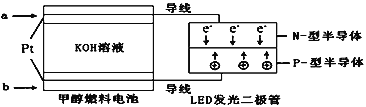
��д������(ͨ��)a����һ���ĵ缫��Ӧʽ_____��ÿ����9.6g�״�ת�Ƶĵ�����Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.01 mol��L1�Ĵ�����Һ�е���pH=7�Ĵ������Һ����ҺpH�����������Һ����仯������ʾ��ͼ����ͼ��ʾ�����з�����ȷ����
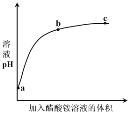
A��a�㣬pH = 2
B��b�㣬c(CH3COO-) > c(NH4+)
C��c�㣬pH���ܴ���7
D��ac�Σ���ҺpH������CH3COOH![]() H+ + CH3COO-�����ƶ��Ľ��
H+ + CH3COO-�����ƶ��Ľ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2(g)+I2(g)![]() 2HI(g)����H= -14.9kJ��mol-1��ij�¶����ڼס������������ܱ������г��뷴Ӧ�����ʼŨ�����±���ʾ�����з�Ӧ�ﵽƽ��ʱ�����c(H2)=0.008mol��L-1�������ж���ȷ��
2HI(g)����H= -14.9kJ��mol-1��ij�¶����ڼס������������ܱ������г��뷴Ӧ�����ʼŨ�����±���ʾ�����з�Ӧ�ﵽƽ��ʱ�����c(H2)=0.008mol��L-1�������ж���ȷ��
��ʼŨ�� | c(H2)/(mol��L-1) | c(I2)/(mol��L-1) | c(HI)(mol��L-1) |
�� | 0.01 | 0.01 | 0 |
�� | 0.02 | 0.02 | 0 |
A.ƽ��ʱ������H2��ת�����Ǽ��е�2��
B.ƽ��ʱ�����л�������ɫ��������
C.ƽ��ʱ���ס����������ı仯ֵ���
D.���¶��£���Ӧ��ƽ�ⳣ��K=0.25
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A.�����£�l mol C6H12�к�̼̼������Ŀһ��С��6NA
B.18g���Ƿ����к��ǻ���ĿΪ0.6NA
C.4.0g��H218O��D216O��ɵĻ����������������Ϊ2NA
D.50g��������Ϊ46%���Ҵ���Һ���������Ʒ�Ӧ���ų�H2�ķ�����ĿΪ0.25NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼�IJ���������������������Դ�����һ����Ҫս�Է���
(1)��ϡ��ˮ��������CO2�������£��ð�ˮ����CO2�ɵõ�NH4HCO3��Һ����֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb��2��10��5��H2CO3�ĵ���ƽ�ⳣ��K1��4��10��7��K2��4��10��11����NH4HCO3��Һ�У�c(NH4��)___________(����>����<����������)c(HCO3��)��NH4HCO3��Һ�������غ����ʽΪ________��
(2)CO2��������ɺϳɵ�̼ϩ�����ϳ���ϩ�ķ�ӦΪ2CO2(g)��6H2(g)C2H4(g)��4H2O(g) ��H����1 L�����ܱ������г���2 mol CO2(g)��n mol H2(g)����һ�������·����÷�Ӧ��CO2��ת�������¶ȡ�Ͷ�ϱ�[ ]�Ĺ�ϵ��ͼ��ʾ��
]�Ĺ�ϵ��ͼ��ʾ��

�ٸ÷�Ӧ����H_______0(����>����<����������)��
��ͼ��x1________(����<����>����������)x2��
����ͼ��B���Ͷ�ϱ�Ϊ2����500��ʱ��ƽ�ⳣ��KB��________��
(3)��ҵ����CO2�����״�ȼ�ϣ���һ���ɺϳɶ����ѡ���֪��298K��101kPa�����£�
��ӦI��CO2(g)��3H2(g)CH3OH(g)��H2O(l) ��H����a kJ��mol��1
��ӦII��2H2(g)��O2(g)2H2O(1) ��H����b kJ��mol��1
��ӦIII��CH3OH(g)CH3OH(l) ��H����c kJ��mol��1
��CH3OH(l)ȼ���ȵ��Ȼ�ѧ����ʽΪ_________��
�ںϳɶ����ѵ��ܷ�ӦΪ2CO2(g)��6H2(g)CH3OCH3(g)��3H2O(g) ��H����130.8 kJ��mol��1����ijѹǿ�£��ϳɶ����ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ��ʾ��T1�¶��£���6 mol CO2��12 mol H2����2 L���ܱ������У�5min��Ӧ�ﵽƽ��״̬����0��5min�ڵ�ƽ����Ӧ����v(CH3OCH3)��______________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����ȼ�ϵ�ع���ʱ�������ı�״����11.2 L H2����ת�Ƶ�����Ϊ6.02��1023
B. �����£���ϡCH3COONa��Һ��ˮϡ�ͺ�n(H��)�qn(OH��)����
C. �ϳɰ������н�NH3Һ�����룬�ɼӿ�����Ӧ���ʣ����H2��ת����
D. ��Ӧ2NaCl(s)==2Na(s)��Cl2(g)����H<0����S>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pHֵΪ3��CH3COOH��pHΪ11��NaOH��Һ�������ϣ���Ϻ���ҺpHΪ�� ��
A. pH��7 B. pH�� 7 C. pH��7 D. ���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�졣�ڳ����°������·������ʵ�顣
ʵ���� | ��Ӧ�� | ���� |
�� | 10mL2%H2O2��Һ | �� |
�� | 10mL5%H2O2��Һ | �� |
�� | 10mL5%H2O2��Һ | 1mL0.1mol��L��1FeCl3��Һ |
�� | 10mL5%H2O2��Һ������HCl��Һ | 1mL0.1mol��L��1FeCl3��Һ |
�� | 10mL5%H2O2��Һ������NaOH��Һ | 1mL0.1mol��L��1FeCl3��Һ |
��1��ʵ��ٺ͢ڵ�Ŀ����___��
��2��ʵ��ۢܢ��У�������������������ʱ��仯�Ĺ�ϵ��ͼ1������ͼ1�ܹ��ó���ʵ�������__��

��3������0.1gMnO2��ĩ��50mLH2O2��Һ�У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ2��ʾ����Ӧ���ʱ仯��ԭ����__��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com