
����Ŀ����ѧ�Ҷ�һ̼��ѧ�����˹㷺������о���ȡ����һЩ��Ҫ�ɹ���
��1����֪��CO(g)+2H2(g) ![]() CH3OH(g) ��H1����90.0kJ/mol��
CH3OH(g) ��H1����90.0kJ/mol��
3CH3OH(g) ![]() CH3CH=CH2(g)+3H2O(g) ��H2����31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) ��H2����31.0kJ/mol
CO��H2�ϳ�CH3CH=CH2���Ȼ�ѧ����ʽΪ________��
��2���״���CH3OH������Ϊ������������ȼ�ϣ���ҵ�Ͽ���CO�� H2�ڴ��������ºϳɼ״����������Ϊ2L�ĺ��ݾ����ܱ������У�����1molCO ��2mo1H2������Ӧ��CO(g)+2H2(g) ![]() CH3OH(g) ��H1��-90.0kJ/mol������Ӧ���е�5minʱ�ﵽƽ��״̬����ʱCH3OH�����ʵ���Ϊ0.6mol����
CH3OH(g) ��H1��-90.0kJ/mol������Ӧ���е�5minʱ�ﵽƽ��״̬����ʱCH3OH�����ʵ���Ϊ0.6mol����
��5 min�ڷ�Ӧ��ƽ��������(H2) = _____ mol/(L��min)��
�ڴﵽƽ��ʱ�ų�������Ϊ________ kJ
�۲���˵���÷�Ӧ�Ѵﵽƽ��״̬����____��ѡ����ĸ��ţ�
a��CO�����ʵ������ٸı� b���������¶ȱ��ֲ���
c��CH3OH����������������������� d�������ڵ��ܶȱ��ֲ���
��3��һ�ּ״�ȼ�ϵ����ͼ��ʹ�õĵ������Һ��2mol��L��1��KOH��Һ��
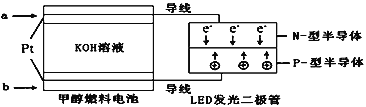
��д������(ͨ��)a����һ���ĵ缫��Ӧʽ_____��ÿ����9.6g�״�ת�Ƶĵ�����Ϊ_______��
���𰸡�3CO(g)+6H2(g) CH3CH=CH2(g)+3H2O(g)��H��-301.0kJ/mol 0.12 54 d CH3OH��6e��+8OH��=CO32-+6H2O 1.8NA(1.8��6.02��1023)
��������
(1)��CO(g)+2H2(g)![]() CH3OH(g)��H1=-90.1kJ/mol����3CH3OH(g)
CH3OH(g)��H1=-90.1kJ/mol����3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g)��H2=-31.0kJ/mol����˹���ɼ������3+�ڵõ�CO��H2�ϳ�CH3CH=CH2���Ȼ�ѧ����ʽ��
CH3CH=CH2(g)+3H2O(g)��H2=-31.0kJ/mol����˹���ɼ������3+�ڵõ�CO��H2�ϳ�CH3CH=CH2���Ȼ�ѧ����ʽ��
(2)����Ӧ���е�5minʱ�ﵽƽ��״̬����ʱCH3OH�����ʵ���Ϊ0.6mol����Ϸ�ӦCO(g)+2H2(g) ![]() CH3OH(g)��֪�μӷ�Ӧ��H2�����ʵ���Ϊ1.2mol��
CH3OH(g)��֪�μӷ�Ӧ��H2�����ʵ���Ϊ1.2mol��
��5 min�ڷ�Ӧ��ƽ��������(H2) =![]() ��
��
�ڽ���Ȼ�ѧ��Ӧ����ʽ����ﵽƽ��ʱ�ų���������
�۸��ݻ�ѧƽ��״̬���������淴Ӧ������ȣ�����ֺ������ֲ��������
(3)���ݵ��ӷ���aΪ������Ϊ�״�����������Ӧ���ɶ�����̼���ݴ���д���ɵ缫��Ӧ��֪��ÿ����1mol�״�ת�Ƶ���6mol��9.6g�״�Ϊ![]() =0.3mol���ݴ˼��㡣
=0.3mol���ݴ˼��㡣
(1)��CO(g)+2H2(g)CH3OH(g)��H1=-90.1kJ/mol����3CH3OH(g)CH3CH=CH2(g)+3H2O(g)��H2=-31.0kJ/mol����˹���ɼ������3+�ڵõ�CO��H2�ϳ�CH3CH=CH2���Ȼ�ѧ����ʽ��3CO(g)+6H2(g)CH3CH=CH2(g)+3H2O(g)��H=-301.3kJ/mol��
(2)����Ӧ���е�5minʱ�ﵽƽ��״̬����ʱCH3OH�����ʵ���Ϊ0.6mol����Ϸ�ӦCO(g)+2H2(g) ![]() CH3OH(g)��֪�μӷ�Ӧ��H2�����ʵ���Ϊ1.2mol��
CH3OH(g)��֪�μӷ�Ӧ��H2�����ʵ���Ϊ1.2mol��
��5 min�ڷ�Ӧ��ƽ��������(H2) =![]() =
= =0.12 mol/(L��min)��
=0.12 mol/(L��min)��
�ڲμӷ�Ӧ��H2�����ʵ���Ϊ1.2mol����ƽ��ʱ�ų�������Ϊ1.2mol![]() =54kJ��
=54kJ��
��a����Ӧ�ﵽƽ�⣬CO�����ʵ������ٸı䣬��a��ȷ��
b���������¶ȱ��ֲ��䣬˵����Ӧ������Ծ�ֹ״̬����ƽ��״̬����b��ȷ��
c��CH3OH����������������������ȣ�˵��CH3OH�������ٸı䣬�ﵽƽ�⣬��c��ȷ��
d��������=![]() ����Ӧ��Ϊ���壬�������������䣬�������ݣ�V���䣬�������ڵ��ܶ�ʼ�ձ��ֲ��䣬�����ж�ƽ�⣬��d����
����Ӧ��Ϊ���壬�������������䣬�������ݣ�V���䣬�������ڵ��ܶ�ʼ�ձ��ֲ��䣬�����ж�ƽ�⣬��d����
�ʴ�Ϊ��d��
(3)������a������aΪ����������Ϊ�״�ʧȥ���ӷ���������Ӧ���缫��ӦΪ��CH3OH-6e-+8OH-=CO32-+6H2O���ɵ缫��Ӧ��֪��ÿ����1mol�״�ת�Ƶ���6mol��ÿ����9.6g�״�ת�Ƶĵ�����Ϊ![]() ��6��NA=1.8NA(1.8��6.02��1023)��
��6��NA=1.8NA(1.8��6.02��1023)��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2 L���ܱ�������ͨ���������壬������ѧ��Ӧ���������������壬��Ӧ�и����ʵ����ʵ����仯��ͼ��ʾ���Ը÷�Ӧ���ƶϺ�������
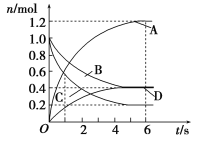
A. �÷�Ӧ�Ļ�ѧ����ʽΪ3B(g)��4D(g)![]() 6A(g)��2C(g)
6A(g)��2C(g)
B. ��Ӧ���е�1 sʱ��v(A)��v(D)
C. ��Ӧ���е�6 sʱ��B��ƽ����Ӧ����Ϊ0.05 mol/(L��s)
D. ��Ӧ���е�6 sʱ�������ʵķ�Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⻯�ƣ�CaH2����һ�ֳ��õĴ�����ϡ�ij��ѧ��ȤС����ȡ�⻯�Ƶ�ʵ��װ����ͼ�����ϣ��⻯��Ҫ�ܷⱣ�棬�ڿ��������ױ��ʡ�����˵������ȷ���ǣ�������
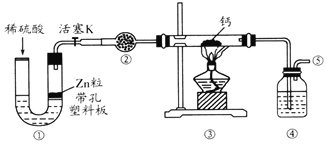
A.�������зֱ�ʢװ��ʯ�Һ�Ũ����
B.��Ӧ������Ӧ��ֹͣ���ȣ�ͨ��һ��ʱ���ٹرջ���K
C.��ȼ�ƾ���ǰ�������Թ��������ռ����岢��ȼ��ͨ�������ж����崿��
D.װ����Ҳ�����ڶ���������Ũ���ᷴӦ�Ʊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧС��̽��FeCl3��Һ��Na2S��Һ�ķ�Ӧ�������ͼװ�ý�������ʵ�飺
������ʢ��0.1 molL-1FeCl3��Һ������ƿ�У��μ�һ����0.1 molL-1Na2S��Һ�����裬���ŵ���������ζ����������A��
������ʢ��0.1 molL-1 Na2S��Һ������ƿ�У��μ�����0.1molL-1 FeCl3��Һ�����裬��������B��
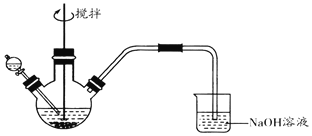
��֪����FeS2Ϊ��ɫ���壬�Ҳ�����ˮ�����ᡣ��Ksp��Fe2S3��=1��10-88��Ksp��FeS2��=6.3��10-31��Ksp[Fe��OH��3]=1��10-38��Ksp��FeS��=4��10-19
�ش��������⣺
(1)NaOH��Һ��������______��
С��ͬѧ�²⣬����A��B����ΪS����������ǵĻ��������������ʵ�����̽����
ʵ��һ��̽��A�ijɷ�
ȡ����A��С�ձ��У���������ʵ�飺
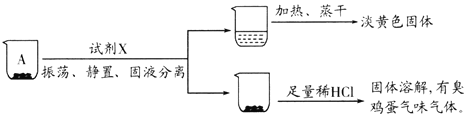
(2)�Լ�X��______���ɴ��ƶ�A�ijɷ���______���ѧʽ����
ʵ�����̽��B�ijɷ�
ȡ����B��С�ձ��У���������ʵ�飺

(3)���Թ�a�м����Լ�Y���۲쵽��������֤����Һ�д���Fe2+���Լ�Y��______������������______���ɴ��ƶ�B�ijɷ���______���ѧʽ����
(4)���������ʵ��δ�õ�Fe��OH��3��ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶�ʱ,��nmol/L�İ�ˮ����10mL0.1mol/L������,��ҺpH���¶�����백ˮ����仯������ͼ��ʾ�������й�˵����ȷ����
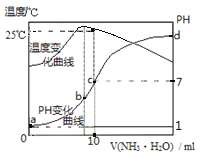
A.a��KW=1.0��10-14
B.ˮ�ĵ���̶ȣ�b>c>a>d
C.b�㣺c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.25��ʱ��һˮ�ϰ��ĵ���ƽ�ⳣ��Ϊ10-7/��10n-1������n��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�
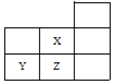
���ݱ�� | ����NaOH��Һ����� | ��Һ��pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() ʱ����Ũ��Ϊ
ʱ����Ũ��Ϊ![]() ������������Һ�ֱ�ζ�
������������Һ�ֱ�ζ�![]() Ũ�Ⱦ�Ϊ
Ũ�Ⱦ�Ϊ![]() ��������HX��
��������HX��![]() ��������仯
��������仯![]() ��ʵ���������2�������ж���ȷ����
��ʵ���������2�������ж���ȷ����![]()
A.ͨ�������ɵñ�����![]() ��
��![]()
B.��������HZ��Һϡ��100����pH��HX��Һ��pH��
C.����ZԪ�صķǽ����Ա�Yǿ������Z�⻯������Խ�ǿ
D.![]()
![]()
![]() ��ˮ��Һ�У�
��ˮ��Һ�У�![]()
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A(g)+B(g)=2C(g)����Ӧ������C�İٷֺ������¶ȹ�ϵ��ͼ��������ȷ����

A.����Ӧ���ʣ�v(c)>v(d)>v(b)
B.��ѧƽ�ⳣ����K(d)>k(c)
C.c��d�仯ʱ��v(��)<v(��)
D.d��״̬������ʵĴ�����ʹc%����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��
��![]() ��
��![]() ������������������ֿ������Σ������£�AC��BD������Һ��
������������������ֿ������Σ������£�AC��BD������Һ��![]() ��BC����Һ
��BC����Һ![]() ��������˵����ȷ����
��������˵����ȷ����![]()
A.AD����Һ![]()
B.��ĵ���̶�һ����![]()
C.��ĵ���̶�һ����![]()
D.��AC����Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��ʱ��ijNaOHϡ��Һ�У�c(H+)=10-amol/L��c(OH-)=10-bmol/L����֪a+b=12����
��1�����¶��£�ˮ�����ӻ�����Kw=___��
��2�����¶��£���100mL0.1mol/L��ϡ������100mL0.4mol/L��NaOH��Һ��Ϻ���Һ��pH=___����ʱ����Һ����ˮ�����c(OH-)=___mol/L��
��3�������£�pH=3��������Һ��pH=11��NaOH��Һ�������Ϻ����Һ��pH___����>7��=7��<7����pH=3�Ĵ�����Һ��pH=11��NaOH��Һ�������Ϻ����Һ��pH___����>7��=7��<7����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com