
【题目】将V1 mL 1.00 mol·L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
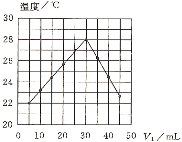
A.做该实验时环境温度为22℃B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是0.67 mol·L-1D.该实验表明有水生成的反应都是放热反应
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.0100mol/L苯酚溶液中滴加0.0100 mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是( )
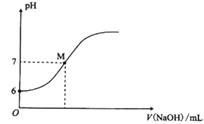
A.25℃时,苯酚的电离常数Ka约为1.0×10-12
B.M点时,所加入NaOH溶液的体积大于10 mL
C.加入20 mLNaOH溶液时,溶液中c(OH-)-c(H+)=c(![]() )
)
D.M点时,溶液中的水不发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.因发生加成反应,苯可使溴水褪色
B.![]() 能使酸性
能使酸性![]() 溶液褪色的同分异构体共有4种
溶液褪色的同分异构体共有4种
C.等物质的量的甲烷和乙酸在氧气中完全燃烧消耗氧气的物质的量前者多
D.在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质X2(X表示为Cl、 Br)与H2反应能量转化关系如下,下列说法不正确的是
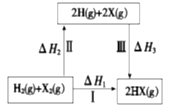
A.过程 II 吸收能量,过程 III 放出能量
B.Cl2(g)+2HBr(g)=Br2(g)+2HCl(g) 该反应能自发进行,则△G﹥0
C.途径I生成HCl时放出的热量比生成HBr时的多,说明生成HCl比生成HBr热力学上趋势更大
D.生成HX的反应热与途径无关,△H1 = △H2 +△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定其性质,元素周期表和元素周期律揭示了化学元素间的内在联系,使其构成了一个完整的体系。回答下列问题:
(1)在硼、氮、氧、氟中,第一电离能由大到小排序为___________(用元素符号表示,下同)。四种元素中的基态原子中,未成对电子数最多的是___________。
(2)已知硼酸的电离方程式为H3BO3+H2O![]() [B(OH)4]+H+。
[B(OH)4]+H+。
①硼酸是___________元酸。
②[B(OH)4]-中含有的化学键类型有___________(填标号)。
a.σ键 b.π键 c.配位键 d.非极性键
③由[B(OH)4]-推出[Al(OH)4]-的结构式为______________________。
(3)氟化硝酰(NO2F)与NO3-的结构相似,则其分子的立体构型是___________,N原子的杂化轨道类型为___________。
(4)已知单质硼晶体的熔点为1873℃,单质硼晶体是___________晶体。
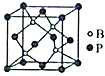
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示。已知晶胞中B-P键键长均为anm,阿伏加德罗常数的值为NA,则磷化硼晶体的密度为___________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美、德两国成功合成具有化学特性的氢铝化合物![]() ,关于氢铝化合物的推测不正确的是( )
,关于氢铝化合物的推测不正确的是( )
A.氢铝化合物中铝显![]() 价,氢显
价,氢显![]() 价
价
B.氢铝化合物与水反应生成氢氧化铝和氢气
C.铝与水蒸气高温下反应生成氢铝化合物
D.氢铝化合物具有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是优质抗炎镇痛药,合成原理如下:
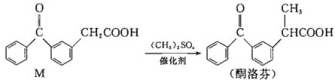
下列说法正确的是( )
A.M和酮洛芬都能发生酯化、卤代和加成反应
B.M和酮洛芬分子中所有碳原子都可能共平面
C.M和酮洛芬在一定条件下最多消耗![]() 的物质的量相等
的物质的量相等
D.M分子中苯环上一氯代物有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活及工业生产密切相关。下列有关说法正确的是![]()
A.高炉炼铁、煅烧石灰石和海水提镁的过程中均涉及氧化还原反应
B.煤经过气化和液化等物理变化后,可得到清洁燃料
C.由于![]() 具有较强的氧化性,
具有较强的氧化性,![]() 常用作净水剂
常用作净水剂
D.静电除尘治理悬浮颗粒污染的依据是胶体粒子带有电荷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com