
【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。

【答案】1s22s22p63s23p64s1 ![]() < 大于 sp3 与Ca2+、Sr2+相比,钡离子由于半径大和氧离子结合更难, 所以碳酸钡分解温度高 PCl4+ PCl6- d3·ρ·10-30
< 大于 sp3 与Ca2+、Sr2+相比,钡离子由于半径大和氧离子结合更难, 所以碳酸钡分解温度高 PCl4+ PCl6- d3·ρ·10-30 ![]()
【解析】
(1)根据核外电子排布规律书写基态钾原子的电子排布和氮原子的价电子排布图;
(2)金属元素第一电离能较小,非金属元素第一电离能较大;
(3)根据相似相溶原理确定溶解度,根据白磷分子结构确定![]() 分子中原子轨道杂化类型;
分子中原子轨道杂化类型;
(4)根据阳离子半径,推测碳酸钡分解温度最高的原因;
(5)结合等电子体原理,推断与![]() 、
、![]() 互为等电子体的A、B两种离子的符号;
互为等电子体的A、B两种离子的符号;
(6)分析晶胞结构,结合“均摊法”及晶胞边长、密度计算晶胞的质量及NA。
(1)![]() 的核电荷数是20,由排布规律可知其核外电子排布式为
的核电荷数是20,由排布规律可知其核外电子排布式为![]() ,
,![]() 的价电子数为5,根据洪特规则其价电子排布图为
的价电子数为5,根据洪特规则其价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)![]() 是非金属,
是非金属,![]() 是金属,故
是金属,故![]() 的第一电离能小于
的第一电离能小于![]() ,故答案为:<;
,故答案为:<;
(3)白磷![]() 和
和![]() 均是非极性分子,水是极性分子,根据相似相溶原理可知白磷在
均是非极性分子,水是极性分子,根据相似相溶原理可知白磷在![]() 中的溶解度比在水中大;
中的溶解度比在水中大;![]() 分子结构类似于白磷
分子结构类似于白磷![]() ,故
,故![]() 中的氮原子形成3个共价单键,有1对孤对电子,故采取
中的氮原子形成3个共价单键,有1对孤对电子,故采取![]() 杂化,故答案为:大于;
杂化,故答案为:大于;![]() ;
;
(4)三种阳离子中![]() 的半径最大,与氧离子结合最难,故碳酸钡的分解温度最高,
的半径最大,与氧离子结合最难,故碳酸钡的分解温度最高,
故答案为:与![]() 相比,钡离子由于半径大和氧离子结合更难, 所以碳酸钡分解温度高;
相比,钡离子由于半径大和氧离子结合更难, 所以碳酸钡分解温度高;
(5)晶体为氯化铯型,故A、B离子数之比是1:1, A与![]() 互为等电子体,故A为
互为等电子体,故A为![]() B与
B与![]() 互为等电子体,故B为
互为等电子体,故B为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(6)金属钙是面心立方最密堆积,每个晶胞中含有钙原子数为![]() ,晶胞边长为
,晶胞边长为![]() ,则晶胞的体积为
,则晶胞的体积为![]() ,又知钙的密度是
,又知钙的密度是![]() ,故每个晶胞的质量为
,故每个晶胞的质量为![]() ,每个晶胞含有4个钙原子,故
,每个晶胞含有4个钙原子,故![]() ,则
,则![]() ,故答案为:
,故答案为:![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述符合的是( )
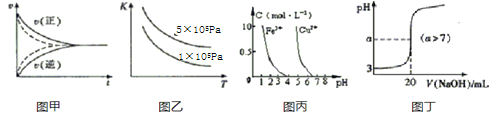
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g) ![]() 2SO3(g)的平衡常数K与温度和压强的关系
2SO3(g)的平衡常数K与温度和压强的关系
C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH=4左右
D.图丁表示常温下向20mL0.001mol/L的醋酸溶液中滴加0.001mol/L的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)写出甲基和羟基的电子式:甲基___,羟基___。
(2)用系统命名法给下列有机物命名:
①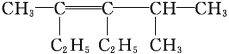 ___;
___;
②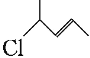 ___。
___。
(3)某物质是苯的同系物,分子式为C9H12,一溴代物只有2种,则该物质的结构简式为___。
(4)写出4—甲基—2—乙基—1—戊烯的键线式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质的分子式为CxHyOz,取该物质a g在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若Na2O2固体的质量增加了b g,且a < b,则该物质的分子式可能是( )
A.C3H6O3B.C3H6O2C.CH2O2D.C3H8O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A.常温下1LpH=2的H3PO4溶液中含有的H+数目为0.01NA
B.0.1mol苯被氧化为CO2转移的电子数为3NA
C.46.0g甘油(丙三醇)中共价键数目为6.5NA
D.18g重水(D2O)中含有的中子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(C—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。
相关化学键的键能如下表所示:
化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)为研究汽车尾气转化为无毒无害的物质的有关反应,在某恒容密闭容器中充入4molCO和4 mol NO,发生反应2CO+2NO![]() 2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
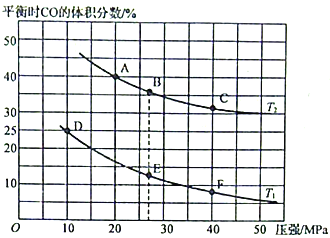
①该可逆反应达到平衡后,为在提高反应速率的同时提高NO的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入CO和NO b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②由图可知,压强为20MPa、温度为T2下的平衡常数Kp=___________MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。保留4位小数)。
③若在B点对反应容器降低温度至T1的同时缩小体积至体系压强增大,达到新的平衡状态时,可能是图中A~F点中的___________点(填标号)。
(3)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(4)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
(5)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
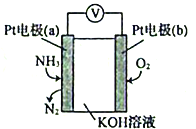
①电极b上发生的是___________反应(填“氧化”或“还原”)。
②电极a的电极反应为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 1.00 mol·L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
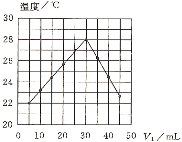
A.做该实验时环境温度为22℃B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是0.67 mol·L-1D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为 890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B.已知强酸与强碱在稀溶液里反应的中和热为 57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+ ![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H = -57.3kJmol-1
BaSO4(s)+H2O(l) △H = -57.3kJmol-1
C.500℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJmol-1
2NH3(g) △H= -38.6kJmol-1
D.已知 25℃、101KPa 条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H= -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则 O2比 O3 稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在如下反应A(g)+3B(g)![]() 2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是( )
2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是( )
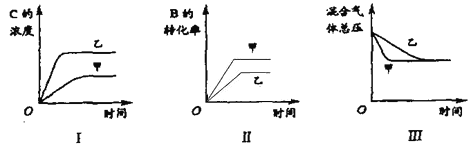
A.图 I 研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com