
【题目】某物质的分子式为CxHyOz,取该物质a g在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若Na2O2固体的质量增加了b g,且a < b,则该物质的分子式可能是( )
A.C3H6O3B.C3H6O2C.CH2O2D.C3H8O3
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】I.被誉为改变未来世界的十大新科技之一的燃料电池。 右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.

试回答下列问题:
(1)燃料电池的优点是________;电解质溶液中的OH-移向______极(填“负”或“正”).
(2)写出氢氧燃料电池工作时正极反应式:_______________________。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________.
(4)利用该装置可以处理氮的氧化物和NH3 尾气,总反应为:6NO2 +8NH3=7N2+12H2O,负极反应式为__________。
II.将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为80 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为41g,试计算:
(1)产生氢气的体积(标准状况)为________________;
(2)通过导线的电子数为__________(用NA表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察![]() Cl-粒子,完成下列问题:
Cl-粒子,完成下列问题:
(1)所含质子数________,中子数________,电子数________,质量数________。
(2)该元素的最高正化合价是________。
(3)该粒子的结构示意图________________,电子式________________。
(4)该粒子与![]() Cl的半径大小的关系是________________。
Cl的半径大小的关系是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于弱电解质的是(填序号,下同)______,属于非电解质是_____。
①硫酸氢钠固体 ②冰醋酸 ③蔗糖 ④氯化氢气体 ⑤硫酸钡 ⑥氨气 ⑦次氯酸钠
(2)写出下列物质在水中的电离方程式:醋酸:______。次氯酸钠:______。
(3)甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,则c(OH﹣)甲:c(OH﹣)乙________ 10(填“大于”、“等于”或“小于”)。
(4)现有常温条件下甲、乙、丙三种溶液,甲为0.1 molL-1的NaOH溶液,乙为0.1 molL-1的HCl溶液,丙为0.1 molL-1的CH3COOH溶液,甲、乙、丙三种溶液中由水电离出的c(OH﹣)的大小关系为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.因发生加成反应,苯可使溴水褪色
B.![]() 能使酸性
能使酸性![]() 溶液褪色的同分异构体共有4种
溶液褪色的同分异构体共有4种
C.等物质的量的甲烷和乙酸在氧气中完全燃烧消耗氧气的物质的量前者多
D.在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下:

下列叙述不正确的是
A. 在NaOH水溶液中加热,化合物X可发生消去反应
B. 在一定条件下,1mol化合物Y可消耗4molBr2
C. 用FeCl3溶液可鉴别化合物X和Y
D. 化合物X与Y中手性碳原子数目比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定其性质,元素周期表和元素周期律揭示了化学元素间的内在联系,使其构成了一个完整的体系。回答下列问题:
(1)在硼、氮、氧、氟中,第一电离能由大到小排序为___________(用元素符号表示,下同)。四种元素中的基态原子中,未成对电子数最多的是___________。
(2)已知硼酸的电离方程式为H3BO3+H2O![]() [B(OH)4]+H+。
[B(OH)4]+H+。
①硼酸是___________元酸。
②[B(OH)4]-中含有的化学键类型有___________(填标号)。
a.σ键 b.π键 c.配位键 d.非极性键
③由[B(OH)4]-推出[Al(OH)4]-的结构式为______________________。
(3)氟化硝酰(NO2F)与NO3-的结构相似,则其分子的立体构型是___________,N原子的杂化轨道类型为___________。
(4)已知单质硼晶体的熔点为1873℃,单质硼晶体是___________晶体。
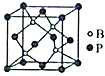
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示。已知晶胞中B-P键键长均为anm,阿伏加德罗常数的值为NA,则磷化硼晶体的密度为___________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 苯佐卡因(![]() )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
B. 香叶醇( )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C. 青蒿素(![]() ) 的一氯代物有5种(不含立体异构)
) 的一氯代物有5种(不含立体异构)
D. 某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com