
【题目】环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染具有重要意义。回答下列问题:
(1)亚硝酰氯(C—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为______________________。
相关化学键的键能如下表所示:
化学键 | Cl—Cl | N≡O(NO气体) | Cl—N | N=O |
键能/(kJ·mol-1) | 243 | 630 | 200 | 607 |
(2)为研究汽车尾气转化为无毒无害的物质的有关反应,在某恒容密闭容器中充入4molCO和4 mol NO,发生反应2CO+2NO![]() 2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
2CO2+N2,平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
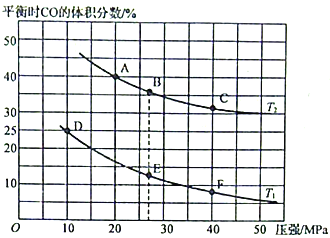
①该可逆反应达到平衡后,为在提高反应速率的同时提高NO的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入CO和NO b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②由图可知,压强为20MPa、温度为T2下的平衡常数Kp=___________MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。保留4位小数)。
③若在B点对反应容器降低温度至T1的同时缩小体积至体系压强增大,达到新的平衡状态时,可能是图中A~F点中的___________点(填标号)。
(3)有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为______________________。
(4)用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中![]() ,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
,则该混合溶液的pH=___________(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2,K a2=1.0×10-7)。
(5)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
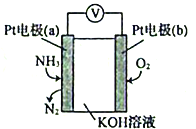
①电极b上发生的是___________反应(填“氧化”或“还原”)。
②电极a的电极反应为_______________________。
【答案】2NO(g)+Cl2(g)=2ClNO(g)△H=-111kJ/mol; ad 0.0023MPa-1 F 4H2S+2NO2═N2+4H2O+4S 6 还原 2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)根据反应的焓变△H=反应物总键能-生成物总键能,据此计算;
(2)①根据图像,升高温度,平衡时CO的体积分数增大,平衡逆向移动,说明该反应的正反应是反应前后气体体积减小的放热反应,据此分析判断;
②由图可知,压强为20MPa、温度为T2下,平衡时CO的体积分数为40%,设参加反应的n(CO)=xmol,根据三段式计算解答;
③相同压强下降低温度平衡正向移动,NO体积分数减小,同一温度下增大压强平衡正向移动NO体积分数减小,据此分析判断;
(3)CH4还原SO2,生成一种含硫质量分数约为94%的化合物为H2S,NO2氧化H2S的生成物可减少氮氧化物对环境的污染,即生成N2和S单质,据此写出化学方程式;
(4) 根据![]() =
=![]() =
=![]() 计算c(H+),再求混合溶液的pH;
计算c(H+),再求混合溶液的pH;
(5)Pt电极通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,据此分析解答。
Ⅰ.(1)2NO(g)+Cl2(g)2ClNO(g),反应的焓变△H=反应物的键能之和-生成物的键能之和243kJ/mol+2×630kJ/mol-2×(200kJ/mol+607kJ/mol)=-111kJ/mol,故答案为:2NO(g)+Cl2(g)2ClNO(g)△H=-111kJ/mol;
(2)①a.按体积比1∶1再充入CO和NO,相当于增大压强,平衡正向移动,NO转化率提高,故a正确;b.改用高效催化剂,只改变化学反应速率不影响平衡移动,所以NO转化率不变,故b错误;c.根据图像,升高温度,平衡时CO的体积分数增大,平衡逆向移动,NO转化率降低,故c错误;d.增加CO的浓度,平衡正向移动,NO转化率提高,故d正确;故答案为:ad;
②由图可知,压强为20MPa、温度为T2下,平衡时CO的体积分数为40%,设参加反应的n(CO)=xmol,
2NO(g)+2CO(g)2CO2(g)+N2(g)
开始(mol)440 0
反应(mol) xx x 0.5x
平衡(mol)4-x 4-x x0.5x
平衡时混合气体物质的量=(4-x+4-x+x+0.5x)mol=(8-0.5x)mol,平衡时NO的体积分数平衡时CO的体积分数=![]() ×100%=40%,x=1,平衡时P(NO)=
×100%=40%,x=1,平衡时P(NO)=![]() ×20MPa=8MPa、P(CO)=
×20MPa=8MPa、P(CO)=![]() ×20MPa=8MPa、P(CO2)=
×20MPa=8MPa、P(CO2)=![]() ×20MPa=
×20MPa=![]() MPa、P(N2)=
MPa、P(N2)=![]() ×20MPa=
×20MPa=![]() MPa,该温度下平衡常数Kp=
MPa,该温度下平衡常数Kp=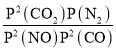 =
=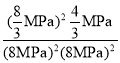 =0.0023MPa-1,故答案为:0.0023MPa-1;
=0.0023MPa-1,故答案为:0.0023MPa-1;
③相同压强下降低温度平衡正向移动,CO体积分数减小,同一温度下增大压强平衡正向移动,CO体积分数减小,所以符合条件的为点F,故答案为:F;
(3)根据原子守恒可知,CH4还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,假设该化合物中含有1个S原子,则该化合物的相对分子质量约为![]() =34,则该化合物为H2S,NO2氧化H2S的生成物对环境无污染,则反应生成N2、S单质和H2O,根据原子守恒,反应的化学方程式为4H2S+2NO2═N2+4H2O+4S,故答案为:4H2S+2NO2═N2+4H2O+4S;
=34,则该化合物为H2S,NO2氧化H2S的生成物对环境无污染,则反应生成N2、S单质和H2O,根据原子守恒,反应的化学方程式为4H2S+2NO2═N2+4H2O+4S,故答案为:4H2S+2NO2═N2+4H2O+4S;
(4) 将一定量的SO2通入到NaOH溶液中,两者完全反应,![]() =
=![]() =
=![]() =
=![]() =
=![]() ,解得c(H+)=1.0×10-6mol/L,则混合溶液的pH=6,故答案为:6;
,解得c(H+)=1.0×10-6mol/L,则混合溶液的pH=6,故答案为:6;
(5)①Pt电极通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,正极上氧气得电子被还原,发生还原反应,故答案为:还原;
②a极为负极,负极是氨气发生氧化反应变成氮气,且OH-向a极移动,参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O。


科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于弱电解质的是(填序号,下同)______,属于非电解质是_____。
①硫酸氢钠固体 ②冰醋酸 ③蔗糖 ④氯化氢气体 ⑤硫酸钡 ⑥氨气 ⑦次氯酸钠
(2)写出下列物质在水中的电离方程式:醋酸:______。次氯酸钠:______。
(3)甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,则c(OH﹣)甲:c(OH﹣)乙________ 10(填“大于”、“等于”或“小于”)。
(4)现有常温条件下甲、乙、丙三种溶液,甲为0.1 molL-1的NaOH溶液,乙为0.1 molL-1的HCl溶液,丙为0.1 molL-1的CH3COOH溶液,甲、乙、丙三种溶液中由水电离出的c(OH﹣)的大小关系为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下:

下列叙述不正确的是
A. 在NaOH水溶液中加热,化合物X可发生消去反应
B. 在一定条件下,1mol化合物Y可消耗4molBr2
C. 用FeCl3溶液可鉴别化合物X和Y
D. 化合物X与Y中手性碳原子数目比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图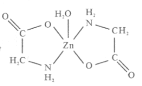 。
。
(1)基态Zn2+的价电子排布式为_______________;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是___________________。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为______________;甘氨酸易溶于水,试从结构角度解释___________________________________________。
(3)一水合甘氨酸锌中Zn2+的配位数为______________________。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1 mol IMI中含有________个σ键。
,则1 mol IMI中含有________个σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物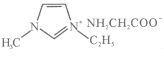 为液态而非固态,原因是________________________________________。
为液态而非固态,原因是________________________________________。
(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
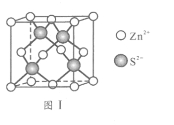
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2- 、Zn2+相切?_________(填“能”或“否”);已知晶体密度为d g/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定其性质,元素周期表和元素周期律揭示了化学元素间的内在联系,使其构成了一个完整的体系。回答下列问题:
(1)在硼、氮、氧、氟中,第一电离能由大到小排序为___________(用元素符号表示,下同)。四种元素中的基态原子中,未成对电子数最多的是___________。
(2)已知硼酸的电离方程式为H3BO3+H2O![]() [B(OH)4]+H+。
[B(OH)4]+H+。
①硼酸是___________元酸。
②[B(OH)4]-中含有的化学键类型有___________(填标号)。
a.σ键 b.π键 c.配位键 d.非极性键
③由[B(OH)4]-推出[Al(OH)4]-的结构式为______________________。
(3)氟化硝酰(NO2F)与NO3-的结构相似,则其分子的立体构型是___________,N原子的杂化轨道类型为___________。
(4)已知单质硼晶体的熔点为1873℃,单质硼晶体是___________晶体。
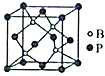
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示。已知晶胞中B-P键键长均为anm,阿伏加德罗常数的值为NA,则磷化硼晶体的密度为___________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试管实验操作简单,现象明显。以下试管实验操作及现象均正确的是( )
![]()
A. 直接向淀粉水解液中滴加新制氢氧化铜悬浊液,加热,产生砖红色沉淀
B. 向苯中滴加少量溴的四氯化碳溶液,充分振荡后静置,分层,上层无色,下层橙红色
C. 向FeSO4 溶液中滴加 K3[Fe(CN)6]溶液,振荡,溶液变血红色
D. 用一束强光照射鸡蛋白溶液,产生一条光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸是一种合成药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
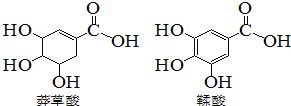
A. 莽草酸分子式为C7H10O5
B. 两种酸都能与溴水发生加成反应
C. 鞣酸分子与莽草酸分子互为同系物
D. 等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com