
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为 890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B.已知强酸与强碱在稀溶液里反应的中和热为 57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+ ![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H = -57.3kJmol-1
BaSO4(s)+H2O(l) △H = -57.3kJmol-1
C.500℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJmol-1
2NH3(g) △H= -38.6kJmol-1
D.已知 25℃、101KPa 条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H= -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则 O2比 O3 稳定
【答案】D
【解析】
A、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,氢元素应该转化成液态水,选项A错误;
B、硫酸和氢氧化钡溶液的反应中,硫酸根和钡离子反应生成硫酸钡沉淀也伴随着能量变化,选项B错误;
C、合成氨的反应为可逆反应,不能进行到底,题给信息无法确定该反应的焓变,选项C错误;
D、已知25℃、101KPa条件下:①4Al(s)+3O2(g)=2A12O3(s) △H=-2834.9 kJ·mol-1,②4Al(s)+2O3(g)=2A12O3(s) △H=-3119.1 kJ·mol-1,根据盖斯定律:①-②得3O2(g)=2O3(g),△H=+288.2 kJ·mol-1,则O2比O3稳定,选项D正确。
答案选D。


 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】观察![]() Cl-粒子,完成下列问题:
Cl-粒子,完成下列问题:
(1)所含质子数________,中子数________,电子数________,质量数________。
(2)该元素的最高正化合价是________。
(3)该粒子的结构示意图________________,电子式________________。
(4)该粒子与![]() Cl的半径大小的关系是________________。
Cl的半径大小的关系是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定其性质,元素周期表和元素周期律揭示了化学元素间的内在联系,使其构成了一个完整的体系。回答下列问题:
(1)在硼、氮、氧、氟中,第一电离能由大到小排序为___________(用元素符号表示,下同)。四种元素中的基态原子中,未成对电子数最多的是___________。
(2)已知硼酸的电离方程式为H3BO3+H2O![]() [B(OH)4]+H+。
[B(OH)4]+H+。
①硼酸是___________元酸。
②[B(OH)4]-中含有的化学键类型有___________(填标号)。
a.σ键 b.π键 c.配位键 d.非极性键
③由[B(OH)4]-推出[Al(OH)4]-的结构式为______________________。
(3)氟化硝酰(NO2F)与NO3-的结构相似,则其分子的立体构型是___________,N原子的杂化轨道类型为___________。
(4)已知单质硼晶体的熔点为1873℃,单质硼晶体是___________晶体。
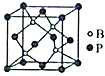
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示。已知晶胞中B-P键键长均为anm,阿伏加德罗常数的值为NA,则磷化硼晶体的密度为___________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美、德两国成功合成具有化学特性的氢铝化合物![]() ,关于氢铝化合物的推测不正确的是( )
,关于氢铝化合物的推测不正确的是( )
A.氢铝化合物中铝显![]() 价,氢显
价,氢显![]() 价
价
B.氢铝化合物与水反应生成氢氧化铝和氢气
C.铝与水蒸气高温下反应生成氢铝化合物
D.氢铝化合物具有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试管实验操作简单,现象明显。以下试管实验操作及现象均正确的是( )
![]()
A. 直接向淀粉水解液中滴加新制氢氧化铜悬浊液,加热,产生砖红色沉淀
B. 向苯中滴加少量溴的四氯化碳溶液,充分振荡后静置,分层,上层无色,下层橙红色
C. 向FeSO4 溶液中滴加 K3[Fe(CN)6]溶液,振荡,溶液变血红色
D. 用一束强光照射鸡蛋白溶液,产生一条光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是优质抗炎镇痛药,合成原理如下:
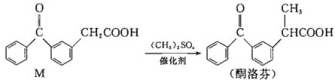
下列说法正确的是( )
A.M和酮洛芬都能发生酯化、卤代和加成反应
B.M和酮洛芬分子中所有碳原子都可能共平面
C.M和酮洛芬在一定条件下最多消耗![]() 的物质的量相等
的物质的量相等
D.M分子中苯环上一氯代物有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 苯佐卡因(![]() )是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
)是局部麻醉药,分子中含有2种官能团,分子式为C9H10NO2
B. 香叶醇( )能发生加成反应不能发生取代反应
)能发生加成反应不能发生取代反应
C. 青蒿素(![]() ) 的一氯代物有5种(不含立体异构)
) 的一氯代物有5种(不含立体异构)
D. 某有机物的分子式为C4H8,能使溴的CCl4溶液褪色,则它在一定条件下与水反应时最多可生成的有机物(不考虑立体异构)有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知 1 molSO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1 。
2SO3(g)反应过程的能量变化如图所示。已知 1 molSO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1 。

请回答下列问题:
(1)图中A、C分别表示____________________、___________________,E的大小对该反应的反应热有无影响?________________。该反应通常用 V2O5 作催化剂,加V2O5会使图中B点升高还是降低?__________, 理由是______________________;
(2)图中ΔH=_____kJ·mol-1;
(3) V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_____;
(4)已知单质硫的标准燃烧热 ΔH=﹣296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)放出的热量 为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com