
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知 1 molSO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1 。
2SO3(g)反应过程的能量变化如图所示。已知 1 molSO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1 。

请回答下列问题:
(1)图中A、C分别表示____________________、___________________,E的大小对该反应的反应热有无影响?________________。该反应通常用 V2O5 作催化剂,加V2O5会使图中B点升高还是降低?__________, 理由是______________________;
(2)图中ΔH=_____kJ·mol-1;
(3) V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_____;
(4)已知单质硫的标准燃烧热 ΔH=﹣296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)放出的热量 为_____________。
【答案】反应物能量(或2molSO2和1molO2气体总能量) 生成物能量 (或2molSO3气体总能量) 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低 -198 SO2+V2O5=SO3+2VO2、4VO2+O2=2V2O5 1185 kJ
【解析】
(1)图中A表示反应物总能量(或2molSO2和1molO2气体总能量),C表示生成物总能量(或2molSO3气体总能量);E为活化能,使用催化剂,活化能降低,活化分子数增加,活化分子百分数增加。E的大小对该反应的反应热没有影响;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,是因为催化剂改变了反应历程,使活化能E降低;
(2)1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1,所以2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-198kJ·mol-1;
2SO3(g) ΔH=-198kJ·mol-1;
(3)根据所给元素化合价的变化可写出反应的方程式,SO2+V2O5=SO3+2VO2,4VO2+O2=2V2O5;
(4)考查盖斯定律的应用。由反应① 2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-198 kJ·mol-1和②S (s)+O2(g)SO2(g) ΔH=-296 kJ·mol-1联立即①+②×2得2S(s)+3O2(g)=2SO3(g) ΔH=-790 kJ·mol-1,所以由S(s)生成3 mol SO3(g)的ΔH=1 185kJ·mol-1。
2SO3(g) ΔH=-198 kJ·mol-1和②S (s)+O2(g)SO2(g) ΔH=-296 kJ·mol-1联立即①+②×2得2S(s)+3O2(g)=2SO3(g) ΔH=-790 kJ·mol-1,所以由S(s)生成3 mol SO3(g)的ΔH=1 185kJ·mol-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为 890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B.已知强酸与强碱在稀溶液里反应的中和热为 57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+ ![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H = -57.3kJmol-1
BaSO4(s)+H2O(l) △H = -57.3kJmol-1
C.500℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJmol-1
2NH3(g) △H= -38.6kJmol-1
D.已知 25℃、101KPa 条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H= -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则 O2比 O3 稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中存在如下反应A(g)+3B(g)![]() 2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是( )
2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图,下列判断一定错误的是( )
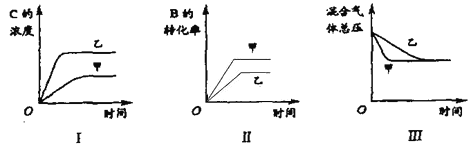
A.图 I 研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
查看答案和解析>>
科目:高中化学 来源: 题型:
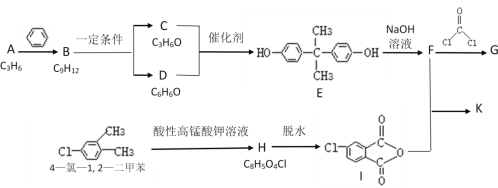
【题目】光气(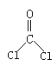 )界面缩聚法合成一种高分子化合物聚碳酸酯G的合成路线如图所示:
)界面缩聚法合成一种高分子化合物聚碳酸酯G的合成路线如图所示:
已知:2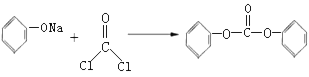 +2NaCl
+2NaCl
(1)C的核磁共振氢谱只有一组吸收峰,C的化学名称为___。
(2)E的分子式为___,H中含有的官能团是氯原子和___,B的结构简式为___。
(3)写出F生成G的化学方程式___。
(4)F与I以1:2的比例发生反应时的产物K的结构简式为___。
(5)H→I时有多种副产物,其中一种含有3个环的有机物的结构简式为___。
(6)4-氯-1,2-二甲苯的同分异构体中属于芳香族化合物的有___种。
(7)写出用2-溴丙烷与D为原料,结合题中信息及中学化学所学知识合成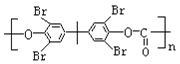 的路线,无机试剂任取。______(已知:一般情况下,溴苯不与NaOH溶液发生水解反应)。
的路线,无机试剂任取。______(已知:一般情况下,溴苯不与NaOH溶液发生水解反应)。
例:CH3CH2OH![]() CH2=CH2
CH2=CH2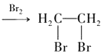
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都为短周期元素,它们在周期表中的位置如图所示。已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C符合的一组是( )

A.铍、钠、铝B.硼、镁、硅C.碳、铝、磷D.氧、磷、氯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)、为了科学饮食,了解一些与食品相关的化学知识是必要的。
(1)油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中不应该充入的是___。
A.氮气 B.二氧化碳 C.空气 D.氧气
(2)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它___。
①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子
(3)能直接鉴别氯化钠和葡萄糖两种未知浓度溶液的方法是___。
A.观察颜色 B.测量密度 C.加热灼烧 D.分别闻味
(二).《化学与生活》良好的生态环境可以提升生活质量。
(1)空气质量报告的各项指标可以反映出各地的空气质量。下列各项中目前未列入我国空气质量报告的是___(填字母)。
a.SO2 b.NO2 c.CO2 d.PM2.5
(2)垃圾应分类收集。以下物质应放置于贴有标志垃圾筒的是___(填字母)。
![]()
a.废电池 b.废铝制的易拉罐 c.建筑固弃物、渣土
(3)近日,公安机关成功破获了一起特大利用“地沟油”制售食用油案件。综合利用“地沟油”的一种方法,通常将“地沟油”进行简单加工提纯后,水解分离可获取___和___(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N![]() N键断裂的同时,有6个N-H键断裂
N键断裂的同时,有6个N-H键断裂
②v(NH3)=0.4mol·L-1·min-1,v(H2)=0.6mol·L-1·min-1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变;
A.②③④B.①②④C.①③④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下6种说法中正确的数目是
![]() 在硝酸蒸气的氛围中蒸干
在硝酸蒸气的氛围中蒸干![]() 溶液会得到
溶液会得到![]() 固体
固体
![]() 溶解度和
溶解度和![]() 一样只与温度有关
一样只与温度有关
![]() 使用精密pH试纸测出84消毒液的pH为
使用精密pH试纸测出84消毒液的pH为![]()
![]() 升温对于强酸、强碱pH不发生变化,弱酸升温pH变小
升温对于强酸、强碱pH不发生变化,弱酸升温pH变小
![]() 滴定氨水用甲基橙做指示剂效果更好
滴定氨水用甲基橙做指示剂效果更好
![]() 实验室制氢气,为加快氢气的生成速率,可向稀硫酸中滴加少量
实验室制氢气,为加快氢气的生成速率,可向稀硫酸中滴加少量![]() 溶液.
溶液.
A.1B.2C.3D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中充入![]() 和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中
和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化的关系如图1所示,其中![]() 阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且
阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且![]() 各改变一种不同的条件。
各改变一种不同的条件。

(1)![]() 时改变的条件为___________,B的起始物质的量为____________。
时改变的条件为___________,B的起始物质的量为____________。
(2)各阶段平衡时对应的平衡常数如下表所示:
|
|
|
|
|
|
|
|
则![]() 之间的关系为___________。(用“>”、“<”或“=”)。
之间的关系为___________。(用“>”、“<”或“=”)。
(3)![]() 阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
阶段,若A的物质的量变化了0.01 mol,而此阶段中反应体系的能量变化为akJ(a>0),写出此条件下该反应的热化学方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com