
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N![]() N键断裂的同时,有6个N-H键断裂
N键断裂的同时,有6个N-H键断裂
②v(NH3)=0.4mol·L-1·min-1,v(H2)=0.6mol·L-1·min-1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变;
A.②③④B.①②④C.①③④D.③④⑤
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】酮洛芬是优质抗炎镇痛药,合成原理如下:
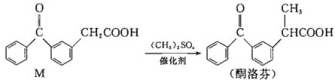
下列说法正确的是( )
A.M和酮洛芬都能发生酯化、卤代和加成反应
B.M和酮洛芬分子中所有碳原子都可能共平面
C.M和酮洛芬在一定条件下最多消耗![]() 的物质的量相等
的物质的量相等
D.M分子中苯环上一氯代物有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活及工业生产密切相关。下列有关说法正确的是![]()
A.高炉炼铁、煅烧石灰石和海水提镁的过程中均涉及氧化还原反应
B.煤经过气化和液化等物理变化后,可得到清洁燃料
C.由于![]() 具有较强的氧化性,
具有较强的氧化性,![]() 常用作净水剂
常用作净水剂
D.静电除尘治理悬浮颗粒污染的依据是胶体粒子带有电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知 1 molSO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1 。
2SO3(g)反应过程的能量变化如图所示。已知 1 molSO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1 。

请回答下列问题:
(1)图中A、C分别表示____________________、___________________,E的大小对该反应的反应热有无影响?________________。该反应通常用 V2O5 作催化剂,加V2O5会使图中B点升高还是降低?__________, 理由是______________________;
(2)图中ΔH=_____kJ·mol-1;
(3) V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_____;
(4)已知单质硫的标准燃烧热 ΔH=﹣296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)放出的热量 为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F六种主族元素,A、B同周期相邻,A、C同主族相邻,A、B、C三种元素的原子序数之和为31,D元素与A、B、C三种元素既不同周期也不同主族,但D单质与A、B、C单质均可以反应,E是短周期主族中原子半径最大的元素,F是B同周期相邻元素。回答下列问题:
(1)写出C的元素符号:_______________ D在周期表中的位置____________________ 。
(2)B、D可直接化合生成化合物x, x分子与A、D形成的分子的稳定性比较_____________________________。(用化学式表示)
(3)A、B、D可组成离子化合物y的化学式为__________;E与C按1:1形成的化合物的电子式为____________ 。
(4)A、C形成的一种既有氧化性又有还原性的常见化合物,它对环境的影响之一是__________________________。
(5) 标准状况下9g F与A的单质完全燃烧产生的气体通入到1 L 1 mol·L-1的NaOH 溶液中,完全反应后溶液中存在的主要离子是_____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是![]()
![]()
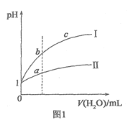

A.图1表示相同温度下![]() 的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.图2中在b点对应温度下,将![]() 的
的![]() 与
与![]() 的NaOH溶液等体积混合后,溶液显中性
的NaOH溶液等体积混合后,溶液显中性
C.图1中,b点酸的总浓度大于a点酸的总浓度
D.图2中纯水仅升高温度,就可以从a点变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据Cd(Hg)+Hg2SO4=3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图。下列有关该电池的说法正确的是( )
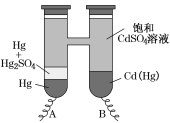
A.电池工作时Cd2+向电极B移动
B.电极A上发生反应Hg2SO4+2e-=2Hg+SO42-
C.电极B上发生反应Cd(Hg)-4e-=Hg2++Cd2+
D.反应中每生成a mol Hg转移3a mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用下面示意图表示的是
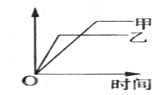
反应 | 纵坐标 | 甲 | 乙 | |
A | SO2与O2在同温、同体积容器中反应 | SO2的转化率 | 2molSO2和1molO2 | 2molSO2和2molO2 |
B | 2molSO2与1molO2在同温、体积可变的恒压容器中反应 | SO2的转化率 | 1×106Pa | 1×105Pa |
C | 相同质量氨,在同一固定容积容器中反应 | 氨气的浓度 | 400℃ | 500℃ |
D | 体积比为1:3的N2、H2在同温、体积可变的恒压容器中反应 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
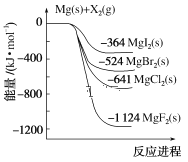
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com