
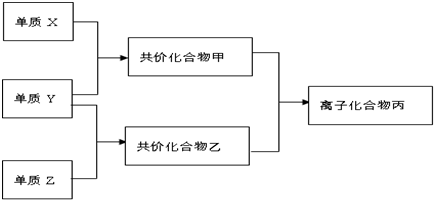
 ,故答案为:
,故答案为: ;
;
| ||


科目:高中化学 来源: 题型:
| A、属于置换反应 |
| B、联氨是氧化剂 |
| C、联氨是还原剂 |
| D、氮气是氧化产物,不是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)将锌片和银片用导线相连浸入稀硫酸中组成原电池.该电池中负极发生
(1)将锌片和银片用导线相连浸入稀硫酸中组成原电池.该电池中负极发生查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 |
 |
 |
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
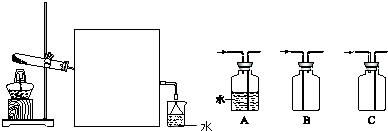
 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.50 | 0.35 | 0.28 | 0.25 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强酸性溶液中:NH4+、K+、ClO-、Cl- |
| B、有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- |
| C、加入铝粉能放出氢气的溶液中:K+、Ba2+、Cl-、Br- |
| D、在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com