
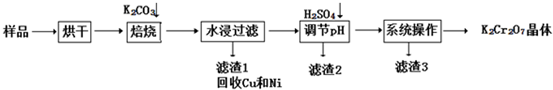
| ||
| ||
| ||


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物一定是金属氧化物 |
| B、金属氧化物一定是碱性氧化物 |
| C、酸性氧化物一定是非金属氧化物 |
| D、非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO3- |
| B、CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 |
| C、等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| D、向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、铜是此反应的催化剂 |
| B、乙醇发生了还原反应 |
| C、生成物M的化学式为C2H4O |
| D、反应中有红黑交替变化的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
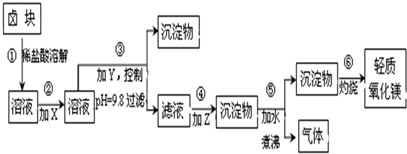
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com