
分析 同种非金属元素之间形成非极性共价键,不同种非金属元素之间形成极性键;
离子键为阴阳离子之间通过静电作用形成的化学键;
含有孤电子对和含有空轨道的原子之间形成配位键;
含有离子键的化合物为离子化合物,其晶体为离子晶体,只含共价键的化合物为共价化合物,形成的晶体为原子晶体或分子晶体;
电荷的分布是不均匀的,不对称的,这样的分子为极性分子;
结构对称,正负电荷的中心重合,则为非极性分子.
解答 解:①NaOH中既有离子键又有共价键,是离子化合物,属于离子晶体;
②H2O2中存在O-O非极性键,H-O极性键,是共价化合物,属于分子晶体,电荷的分布是不均匀的,不对称的,为极性分子;
③NH4Cl中含有离子键、共价键和配位键,是离子化合物,属于离子晶体;
④Na2O2中含有离子键和O-O非极性键,是离子化合物,属于离子晶体;
⑤C2H2中存在C-C非极性键,H-C极性键,是共价化合物,属于分子晶体,结构对称,正负电荷的中心重合,为非极性分子;
⑥SiC晶体中存在C-Si极性共价键,是由碳原子和硅原子通过共价键形成的原子晶体;
⑦Na2S只含有离子键,是离子化合物,属于离子晶体;
⑧单晶硅中存在Si-Si非极性共价键,是由硅原子通过共价键形成的原子晶体;
(1)其中含有极性共价键的原子晶体是:⑥SiC晶体,故答案为:⑥;
(2)其中只含有离子键的离子晶体是:⑦Na2S,故答案为:⑦;
(3)其中既含有离子键又含有非极性共价键的离子晶体是:④Na2O2,故答案为:④;
(4)其中既含有离子键,又含有极性共价键和配位键的离子晶体是:③NH4Cl,故答案为:③;
(5)其中含有极性共价键和非极性共价键的非极性分子是:⑤C2H2,故答案为:⑤;
(6)其中含有极性共价键和非极性共价键的极性分子是:②H2O2,故答案为:②.
点评 本题考查化学键类型、晶体类型、分子极性与非极性的判断,属于对基本概念的考查,题目难度不大,注意非极性分子的结构对称,正负电荷中心重合来,晶体类型的判断依据成键微粒.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
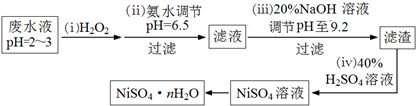
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜分别溶于盐酸和醋酸 | |
| B. | 石灰石分别与硝酸和盐酸反应 | |
| C. | 硫酸铜溶液分别与氯化钡和氢氧化钡溶液反应 | |
| D. | 稀硫酸分别与碳酸钠、碳酸氢钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
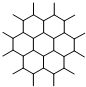
| A. | 1.0 mol•L-1CH3COONa溶液中含有CH3COO-的个数为NA | |
| B. | 1.0 L 1.0 mol•L-1NaAlO2溶液中含有的铝原子数为NA | |
| C. | 如图是石墨晶体结构的俯视图,含1 mol C的石墨中六元环个数为$\frac{{N}_{A}}{2}$ | |
| D. | 22.4 L N2中所含的σ键数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分子 | 立体结构 | 杂化方式 | |
| A | 三氧化硫(SO3) | 正三角形 | S原子采用sp杂化 |
| B | 二氧化硫(SO2) | V型 | S原子采用sp3杂化 |
| C | 碳酸根离子(CO32-) | 三角锥型 | C原子采用sp2杂化 |
| D | 乙炔(C2H2) | 直线型 | C原子采用sp杂化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯使溴水褪色 | |
| B. | 长时间放置的KI溶液变棕色 | |
| C. | 将Na2CO3溶液点在红色石蕊试纸上,试纸变蓝 | |
| D. | 向KSCN与FeCl3的混合溶液中加入FeCl3晶体,溶液颜色加深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com