
分析 碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水,书写化学方程式,根据差量法计算出碳酸氢钠的质量,然后计算出碳酸氢钠的质量分数.
解答 解:碳酸氢钠加热发生的反应方程式为:2NaHO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
根据差量法:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
168 62
m(NaHCO3) (m1-m2)g
混合物中碳酸钠的质量为:m(NaHCO3)=$\frac{168({m}_{1}-{m}_{2})}{62}$g,
则NaHCO3的质量分数为:$\frac{\frac{168({m}_{1}-{m}_{2})}{62}g}{{m}_{1}g}$=$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$,
故答案为:$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握差量法在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 碳酸钙与盐酸反应:CO32-+2 H+=CO2↑+H2O | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,“氢化油”呈液态 | |
| B. | 纤维素和淀粉均属于“糖类,它们在人体内水解的最终产物均为葡萄糖 | |
| C. | 要鉴别石蜡油中是否混有少量苯,可加入四氯化碳,萃取,观察是否分层 | |
| D. | 用灼烧闻气味的方法来区别棉织物和毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
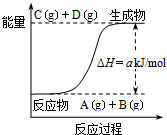
| A. | 该体系的压强不变时标志此反应处于平衡状态 | |
| B. | 若该反应中有电子得失,则可设计成原电池 | |
| C. | 反应物的总键能高于生成物的总键能 | |
| D. | 该反应中的反应物A和B的转化率一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2 $\stackrel{电解}{→}$Mg | |
| C. | Na$→_{△}^{O_{2}}$Na2O2$\stackrel{H_{2}O}{→}$NaOH | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$\stackrel{蔗糖△}{→}$Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
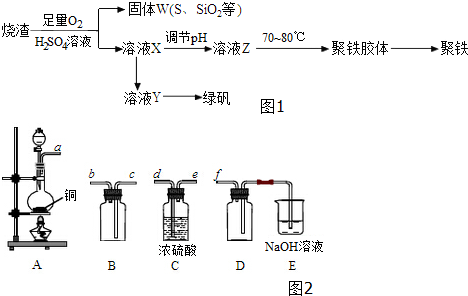
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
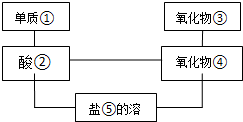 给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.
给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com