
【题目】以反应![]() 为例探究“外界条件对化学反应速率的影响"。实验时,分别量取
为例探究“外界条件对化学反应速率的影响"。实验时,分别量取![]() 溶液和酸性
溶液和酸性![]() 溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 |
| 酸性 | 温度/℃ | ||
浓度 | 体积 | 浓度 | 体积 | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
下列说法不正确的是( )
A.实验①、②、③所加的![]() 溶液均要过量
溶液均要过量
B.实验①测得![]() 溶液的褪色时间为40 s,则这段时间内平均反应速率
溶液的褪色时间为40 s,则这段时间内平均反应速率![]()
C.实验①和②探究浓度对反应速率的影响,实验②、③探究温度对反应速率的影响
D.3组实验中均发现起初反应较慢,过了一会儿速率突然增大,可能是生成的![]() 对反应起催化作用
对反应起催化作用
【答案】B
【解析】
A. 根据反应方程式![]() 并结合实验数据可知,在这三个实验中所加
并结合实验数据可知,在这三个实验中所加![]() 溶液均过量,故A正确;
溶液均过量,故A正确;
B. 高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:0.010mol/L×0.004L/(0.002L+0.004L)=2/3×0.010mol/L,这段时间内平均反应速率v(KMnO4)=2/3×0.010mol/L÷40s=1.7×104 molL1s1,故B错误;
C. 分析表中数据可知,实验①和实验②只是浓度不同,即实验①和实验②是探究浓度对化学反应速率的影响;实验②和③只是温度不同,所以实验②和③是探究温度对化学反应速率的影响,故C正确;
D. 在其它条件都相同时,开始速率很小,过一会儿速率突然增大,说明反应生成了具有催化作用的物质,其中水没有这种作用,CO2释放出去了,所以可能起催化作用的是Mn2+,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
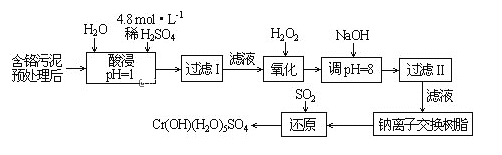
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需______________________。
(2)酸浸时,为了提高浸取率可采取的措施有___________________________。(写出两个措施)
(3)加入H2O2的作用是_____________________________________。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是_______________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是___________________。
(6)写出上述流程中用SO2进行还原的离子方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M具有广谱抗菌活性,合成M的反应可表示如下:

下列说法正确的是
A. X分子中有2个手性碳原子
B. Y分子中所有原子一定不可能在同一平面内
C. 可用FeCl3溶液或NaHCO3溶液鉴别X和Y
D. 在NaOH溶液中,1 mol M最多可与5 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 在元素周期表中的位置如图所示,其中
在元素周期表中的位置如图所示,其中![]() 所处的周期序数与主族序数相等,请回答下列问题:
所处的周期序数与主族序数相等,请回答下列问题:
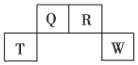
(1)![]() 元素的原子结构示意图为__________________;
元素的原子结构示意图为__________________;![]() 元素在元素周期表中的位置为____________。
元素在元素周期表中的位置为____________。
(2)原子序数比![]() 小2的元素是_________(填元素符号),它的单质在氧气中燃烧的化学方程式为______________________________。
小2的元素是_________(填元素符号),它的单质在氧气中燃烧的化学方程式为______________________________。
(3)原子序数比![]() 大4的元素是______(填元素符号),该元素最高价氧化物的水化物溶液与
大4的元素是______(填元素符号),该元素最高价氧化物的水化物溶液与![]() 元素最高价氧化物的水化物溶液反应的离子方程式为______________________________。
元素最高价氧化物的水化物溶液反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
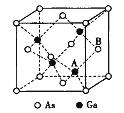
【题目】砷化稼(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]_______________。
(2)根据元素周期律,元素的电负性Ga______(填“大于”或“小于”, 下同)As,第一电离能B ____ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______。
(3)杀虫剂Na3AsO4中阴离子的空问构型为______,As原子采取________杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是____________。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价健数为______;A原子距离B原子所在六面体的侧面的最短距离为______ (用x表示)pm ;该晶胞的密度为_____g·cm-3。(阿伏伽德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都是22.4L
B. 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C. 在标准状况下,体积为22.4L的物质都是1mol
D. 在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,要提高反应的速率和尾气的转化率,采取的措施是( )
2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,要提高反应的速率和尾气的转化率,采取的措施是( )
A.降低温度
B.增大压强
C.在发生反应的密封容器中充入氦气
D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)空气燃料电池是一种环保型碱性燃料电池,电解液是20%~30%的KOH溶液。关于该电池,下列说法正确的是( )
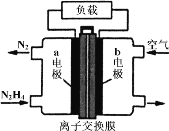
A.负极的电极反应式是:N2H4+4OH-4e-=4H2O+N2↑
B.正极的电极反应式是:O2+4H++4e=2H2O
C.离子交换膜的类型为阳离子交换膜
D.b电极附近pH值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应A(g)+B(g)xC(g)+D(s),在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

A. 反应方程式中x=2
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量D
D. t1~t3间该反应的平衡常数不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com