
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
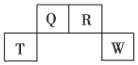
、![]() 在元素周期表中的位置如图所示,其中
在元素周期表中的位置如图所示,其中![]() 所处的周期序数与主族序数相等,请回答下列问题:
所处的周期序数与主族序数相等,请回答下列问题:
(1)![]() 元素的原子结构示意图为__________________;
元素的原子结构示意图为__________________;![]() 元素在元素周期表中的位置为____________。
元素在元素周期表中的位置为____________。
(2)原子序数比![]() 小2的元素是_________(填元素符号),它的单质在氧气中燃烧的化学方程式为______________________________。
小2的元素是_________(填元素符号),它的单质在氧气中燃烧的化学方程式为______________________________。
(3)原子序数比![]() 大4的元素是______(填元素符号),该元素最高价氧化物的水化物溶液与
大4的元素是______(填元素符号),该元素最高价氧化物的水化物溶液与![]() 元素最高价氧化物的水化物溶液反应的离子方程式为______________________________。
元素最高价氧化物的水化物溶液反应的离子方程式为______________________________。
【答案】![]() 第二周期ⅣA族
第二周期ⅣA族 ![]()
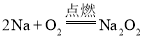
![]()
![]()
【解析】
短周期元素Q、R、T、W,根据元素所处的位置,可确定T、W为第三周期的元素,Q、R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为C元素,R为N元素,W为S元素。
(1)T为Al,原子核外有13个电子,原子结构示意图为![]() ;Q为C,原子核外有2个电子层,最外层电子数为4,在周期表中的位置是第二周期ⅣA族;
;Q为C,原子核外有2个电子层,最外层电子数为4,在周期表中的位置是第二周期ⅣA族;
(2)原子序数比Al小2的元素是Na,在氧气中燃烧生成过氧化钠,反应方程式为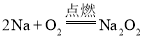 ;
;
(3)原子序数比S大4的元素是Ca,该元素最高价氧化物的水化物是氢氧化钙,S元素最高价氧化物的水化物是硫酸,氢氧化钙溶液与硫酸溶液发生中和反应生成硫酸钙和水,离子方程式为![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.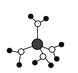 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B.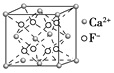 CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
C. H原子的电子云图如图所示为球形
H原子的电子云图如图所示为球形
D. 金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、W六种元素在周期表中的位置如图所示,下列说法不正确的是
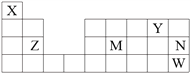
A. 原子半径:r(Z)>r(M)>r(Y)
B. 最高价氧化物对应水化物酸性:M>N
C. N的单质能与Z和W形成的化合物发生置换反应
D. X能与另五种元素形成化合物,且X的化合价不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】模拟石油深加工合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程如图:
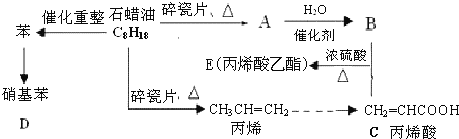
请回答下列问题:
(1)丙烯酸乙酯的含氧官能团名称为____
(2)写出下列反应的化学方程式,并指出反应类型:
①A→B:____,____反应。
②苯→硝基苯:____,____反应。
(3)纯硝基苯是无色、难溶于水,密度比水大,具有苦杏仁味的油状液体。实验室制备硝基苯的装置如图示:
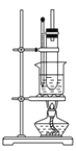
主要步骤如下:
a.配制一定比例的浓硫酸与浓硝酸混合酸,加入反应器中
b.在50~60℃下发生反应,直至反应结束
c.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯
d.向室温下的混合酸中逐滴加入一定质量的苯,充分振荡,混合均匀
e.除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤
回答下列问题:
①实验操作的正确顺序是____(填字母)。
②步骤b中的加热方法为____,步骤e中洗涤和分高粗硝基苯应使用的主要仪器是____,粗产品用5%NaOH溶液洗涤的目的是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比。当电解装置插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀。根据上述现象,下列选项说法正确的是( )
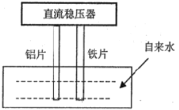
A.通电时,铝片做阳极,铁片做阴极
B.生成的气泡、红棕色或灰绿色的沉淀都是电解的直接或间接产物
C.通过对比,确实能说明自来水中含有大量对人体有毒有害的物质
D.铁片的电极反应:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是( )
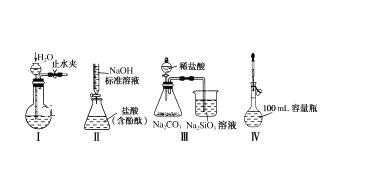
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:测定未知盐酸的浓度
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应![]() 为例探究“外界条件对化学反应速率的影响"。实验时,分别量取
为例探究“外界条件对化学反应速率的影响"。实验时,分别量取![]() 溶液和酸性
溶液和酸性![]() 溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 |
| 酸性 | 温度/℃ | ||
浓度 | 体积 | 浓度 | 体积 | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
下列说法不正确的是( )
A.实验①、②、③所加的![]() 溶液均要过量
溶液均要过量
B.实验①测得![]() 溶液的褪色时间为40 s,则这段时间内平均反应速率
溶液的褪色时间为40 s,则这段时间内平均反应速率![]()
C.实验①和②探究浓度对反应速率的影响,实验②、③探究温度对反应速率的影响
D.3组实验中均发现起初反应较慢,过了一会儿速率突然增大,可能是生成的![]() 对反应起催化作用
对反应起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料制备硼酸(H3BO3),其流程如图1所示,硫酸镁和硼酸的溶解度随温度的变化曲线如图2所示。
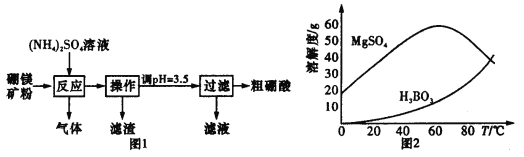
请回答下列问题:
(1)流程中“反应”的实验装置如下图所示:
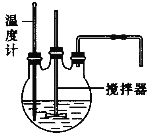
①反应时需控制在95℃进行,控制反应温度的适宜方法是____________________。
②反应产生的气体需要净化处理,请从下图中选择合适的装置__________(填字母代号)。
(2)实验中得到的粗硼酸还需要重结晶进行提纯,重结晶得到的母液可以在下一次重结晶时重复使用,但达到一定次数后必须净化处理,原因是______________________。
(3)实验时若被强碱溅到,先用大量水冲洗,水洗后再涂上硼酸溶液,写出有关离子方程式:____________。
(4)滴定硼酸时不能直接滴定,因为硼酸是很弱的酸,Ka=5.7×10-10。滴定前,须先将硼酸与甘油作用生成甘油硼酸,Ka=8.4×10-6,然后用酚酞作指示剂,再用NaOH标准溶液滴定。已知硼酸的摩尔质量为61.8 g·mol-1,滴定前称取3.00 g硼酸试样,配成250mL溶液,每次取25.00mL于锥形瓶中滴定,消耗0.200 0 mol·L-1 NaOH标准液的平均体积为20.00 mL。
①计算所得硼酸的纯度=__________。
②若用NaOH标准溶液直接滴定硼酸,则硼酸的纯度将__________(填字母代号)。
A.偏大 B.偏小 C.无影响 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用0.2mol·L1Al2(SO4)3溶液滴定0.05mol·L1 NaOH溶液。其pHt曲线如图所示。已知0.01mol·L1Al3+时,Al(OH)3沉淀存在的pH范围为4~10。下列说法正确的是( )
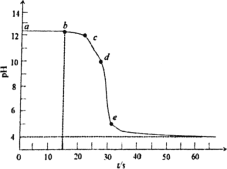
A.曲线段ab为未滴加Al2(SO4)3溶液,溶液只有Na+、OH
B.曲线段bc存在c(Na+)+c(H+)+3c(Al3+)=c(OH)+2c(SO42-)
C.曲线段cd发生反应为Al3++4OH=AlO2-+2H2O
D.曲线段de现象为产生白色沉淀,继而沉淀消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com