
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
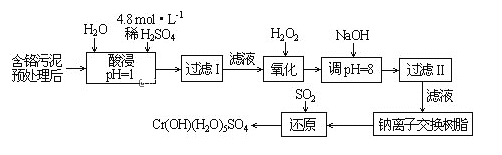
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需______________________。
(2)酸浸时,为了提高浸取率可采取的措施有___________________________。(写出两个措施)
(3)加入H2O2的作用是_____________________________________。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是_______________。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是___________________。
(6)写出上述流程中用SO2进行还原的离子方程式___________________________。
【答案】250mL容量瓶、烧杯 升高反应温度、增大固体颗粒的表面积、加快搅拌速度等 Cr3+转化为Cr2O72- Na+、Mg2+、Ca2+ pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)回收与再利用 Ca2+、Mg2+ 3SO2+ 2Na2CrO4+ 12H2O=2CrOH(H2O)5SO4↓+Na2SO4+ 2NaOH
【解析】
向含铬污泥中加入稀硫酸和水并将溶液pH调节为1,根据信息①知,硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,然后过滤,向滤液中加入双氧水,发生2Cr3++3H2O2+H2O=Cr2O72-+8H+,Cr3+被氧化生成Cr2O72-,然后向溶液中加入NaOH溶液并调节溶液的pH=8,根据表中数据知,溶液中Fe3+、Al3+生成沉淀,且溶液中Cr2O72-转化为CrO42-,然后过滤,向滤液中加入钠离子交换树脂,除去Ca2+和Mg2+,最后向溶液中通入二氧化硫,发生反应2 CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH-,以此来解答。
(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,故答案为250mL容量瓶、胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是升高反应温度、增大固体颗粒的表面积、加快搅拌速度等;故答案为升高反应温度、增大固体颗粒的表面积、加快搅拌速度等。
(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+转化为Cr2O72-;故答案为Cr3+转化为Cr2O72-;
(4)碱性条件下Cr2O72-转化为CrO42-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-,滤液Ⅱ中阳离子主要有Na+、Ca2+、Mg2+;但溶液的pH不能超过8,其理由是pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(Ⅲ)回收与再利用,故答案为pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)回收与再利用;
(5)钠离子交换树脂交换 的离子是Mg2+、Ca2+,从而除去杂质离子Mg2+、Ca2+,故答案为Mg2+、Ca2+;
(6)上述流程中用SO2进行还原时发生反应的化学方程式为3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH,故答案为3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形C22-的存在,使晶胞沿一个方向拉长。则关于CaC2晶体的描述不正确的是( )
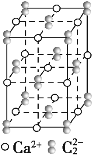
A.CaC2晶体的熔点较高、硬度也较大
B.和Ca2+距离相同且最近的C22-构成的多面体是正八面体
C.和Ca2+距离相同且最近的Ca2+有12个
D.如图的结构中共含有4个Ca2+和4个C22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于 H2O 和 H2S 的说法正确的是
A.H2O 比 H2S 稳定,是因为 H2O 分子间有氢键,而 H2S 分子间只有范德华力
B.二者中心原子杂化方式均为 sp2 杂化
C.H2S 的水溶液呈酸性,而 H2O 成中性,说明 O 元素的非金属性强于 S 元素
D.键角 H2O 大于 H2S,是因为氧的电负性大于硫,两个 O-H 键之间的排斥力大于两个 S-H 键的排斥力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.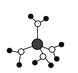 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B.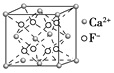 CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
CaF2晶体的晶胞如图所示,与每个Ca2+距离最近的F-为4个
C. H原子的电子云图如图所示为球形
H原子的电子云图如图所示为球形
D. 金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
金属Cu的原子堆积模型如图所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式___。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有___和___。
(3)黄血盐中N原子的杂化方式为____;C、N、O的第一电离能由大到小的排序为___,电负性由大到小的排序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且都位于第四周期,原子序数A<B<C。A、C核外均没有未成对电子,C位于ds区;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布图为__;D和E的电负性大小关系为__(用元素符号表示)。
(2)化合物E2D分子的空间构型为__,中心原子采用_杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_,任意写出一种它的等电子体的化学式为_。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l36.4℃。则该化合物晶体内含有的作用力类型有_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.Fe(OH)3溶于氢碘酸: Fe(OH)3 + 3H+ =Fe3+ + 3H2O
C.泡沫灭火器灭火原理:2A13++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
D.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++ 2OH-+NH4++ HCO3-![]() NH3↑+2H2O+BaCO3↓
NH3↑+2H2O+BaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、W六种元素在周期表中的位置如图所示,下列说法不正确的是
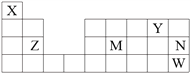
A. 原子半径:r(Z)>r(M)>r(Y)
B. 最高价氧化物对应水化物酸性:M>N
C. N的单质能与Z和W形成的化合物发生置换反应
D. X能与另五种元素形成化合物,且X的化合价不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以反应![]() 为例探究“外界条件对化学反应速率的影响"。实验时,分别量取
为例探究“外界条件对化学反应速率的影响"。实验时,分别量取![]() 溶液和酸性
溶液和酸性![]() 溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 |
| 酸性 | 温度/℃ | ||
浓度 | 体积 | 浓度 | 体积 | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
下列说法不正确的是( )
A.实验①、②、③所加的![]() 溶液均要过量
溶液均要过量
B.实验①测得![]() 溶液的褪色时间为40 s,则这段时间内平均反应速率
溶液的褪色时间为40 s,则这段时间内平均反应速率![]()
C.实验①和②探究浓度对反应速率的影响,实验②、③探究温度对反应速率的影响
D.3组实验中均发现起初反应较慢,过了一会儿速率突然增大,可能是生成的![]() 对反应起催化作用
对反应起催化作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com